
病毒检测;病原检测;融合基因检测;DNA/RNA共检;基因表达分析;药物残留检测

· 更高的检测灵敏度
· 适用于多重qPCR
· 兼容快速程序
· 更优越的储存稳定性
· 高低模板浓度扩增均衡
· 引入 dUTP/UDG 防污染系统

HiScript III U+ One Step qRT-PCR Probe Kit专为以RNA为模板(RNA病毒)的定量PCR检测而设计。整合HiScript III Reverse Transcriptase、RNase inhibitor以及热启动的Champagne Taq DNA Polymerase的优越性能,配合经过优化的缓冲体系,逆转录和qPCR反应在一管内完成,不需要额外的开管/移液操作,大大提高了检测通量,并降低了污染的风险。该产品还引入了dUTP/UDG防污染系统,并且适用于TaqMan等荧光标记探针的高特异性检测系统。此外,本产品还可提供可以冻干的无甘油版本预混液。

优异的扩增性能
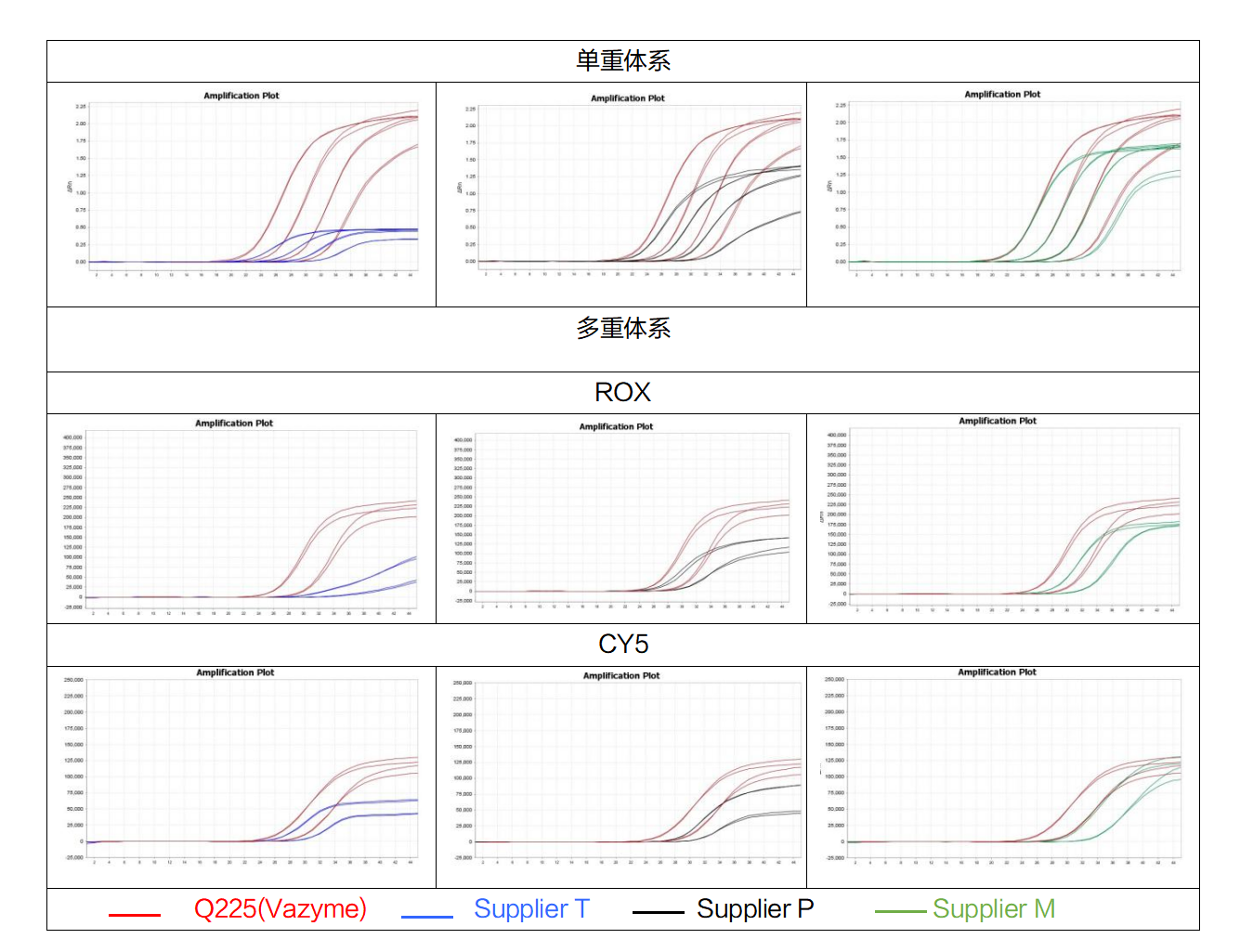
HiScript III U+ One Step qRT-PCR Probe Kit(Vazyme #Q225)和其他品牌的qRT-PCR试剂进行扩增检测。结果表明,Vazyme #Q225在单重体系和多重体系中扩增性能均优于其他竞品。
优越的储存稳定性
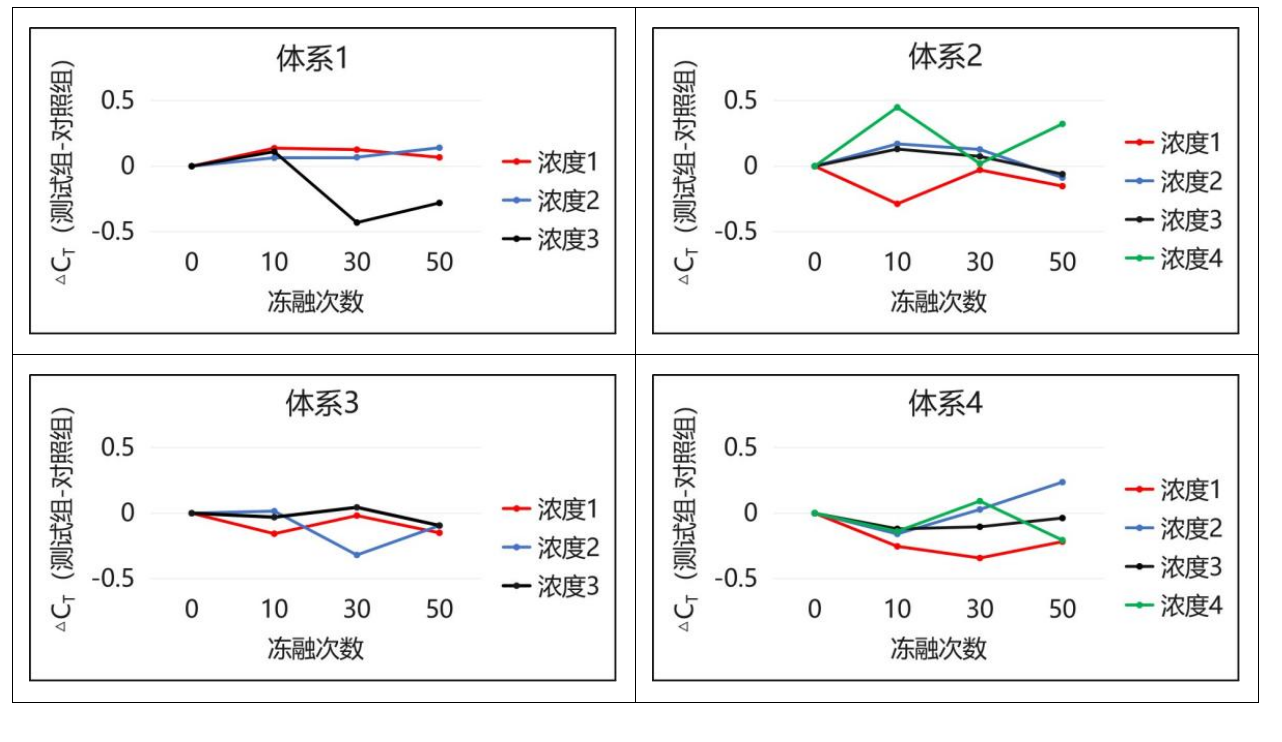
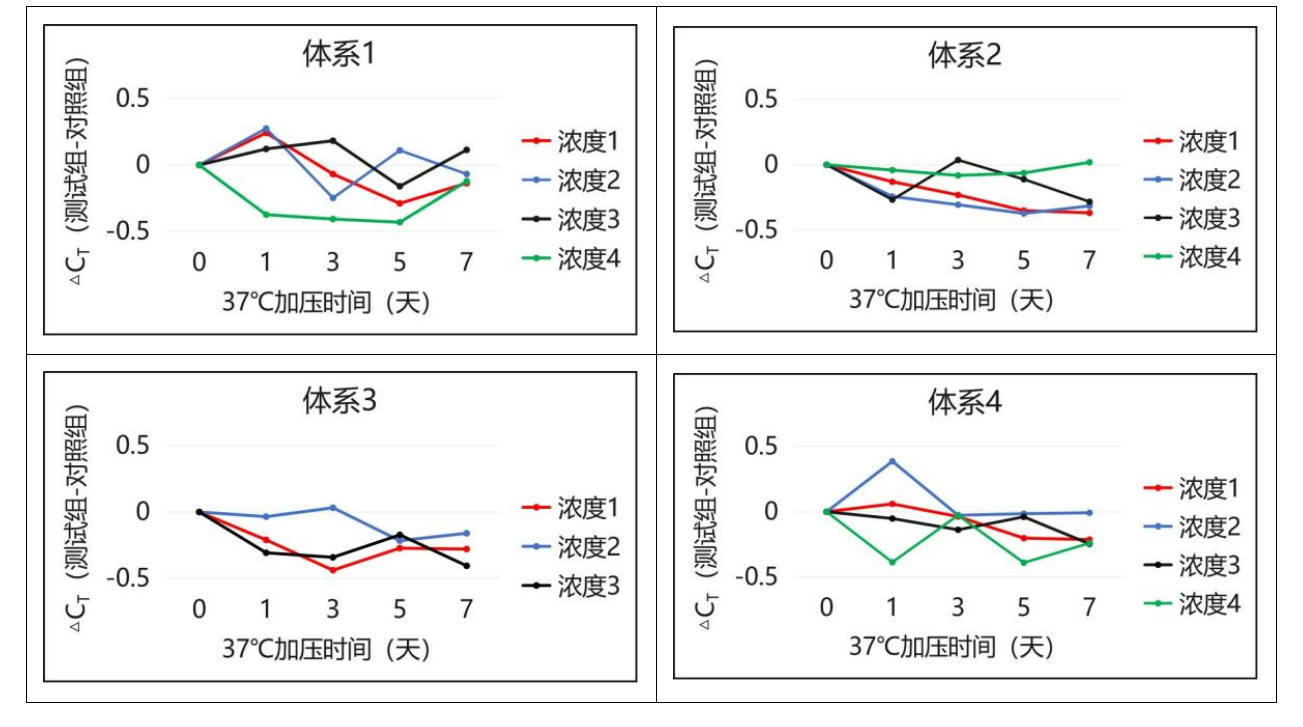
Q225处理组进行反复冻融10次、30次、50次;37℃加压1天、3天、5天、7天,处理组与正常-20℃保存的对照组在不同体系、不同浓度下进行扩增比较。结果表明,Vazyme #Q225试剂具有优越的储存稳定性。
冻融测试:10次、30次、50次
37℃测试:1天、3天、5天、7天

|
组分 |
Q225-01 100 rxns (30 μl/rxn)
|
Q225-02 1,000 rxns (30 μl/rxn)
|
Q225-03 5,000 rxns (30 μl/rxn)
|
|
RNase-free ddH2O |
2 × 1 ml |
20 ml |
100 ml |
|
5 × One Step U+ Mixa |
600 μl |
6 × 1 ml |
30 ml |
|
One Step U+ Enzyme Mixb |
150 μl |
2 × 750 μl |
7.5 ml |
|
50 × ROX Reference Dye 1c |
60 μl |
600 μl |
3 × 1 ml |
|
50 × ROX Reference Dye 2c |
60 μl |
600 μl |
3 × 1 ml |
a. 包含dNTP/dUTP Mix、Mg2+等。
b. 包含HiScript III Reverse Transcriptase、RNase inhibitor、Heat-labile UDG以及Champagne Taq DNA Polymerase。
c. 用以校正孔与孔之间产生的荧光信号误差。使用ABI 7900HT/7300 Real-Time PCR System和StepOnePlus时使用50 × ROX Reference Dye 1;ABI 7500、7500 Fast Real-Time PCR System、Stratagene Mx3000P使用50 × ROX Reference Dye 2;Roche、Bio-Rad的Real Time PCR仪不必使用ROX。

-30 ~ -15℃保存,≤0℃运输。
Q1:如何判断CT值有效性?
A1:(1) 熔解曲线单峰(染料法)
(2) 扩增曲线指数扩增区域,复孔间CT值STD<0.2
(3) 阈值设置合理
(4) NTC确认无气溶胶污染或可以忽略
(5) NRT确认无基因组残留污染或可以忽略
(6) 扩增效率符合近似计算标准,标准曲线相关系数R2大于0.98,扩增效率e介于95-105%或者90-120%之间。
Q2:常见的扩增曲线异常有哪些,如何解决?
A2:(1) 扩增曲线不光滑:信号太弱,经系统矫正后产生。建议提高模板浓度重复实验。
(2) 扩增曲线断裂或下滑:一般由于模板浓度较高,基线的终点值大于CT值。建议减小基线终点(CT值-4),重新分析数据。
(3) 个别扩增曲线突然骤降:反应管内留有气泡,由于温度升高后气泡破裂,使仪器检测到的荧光值突然降低所致。建议反应前要仔细检查反应管内是否有气泡残留。
(4) 扩增曲线呈锯齿状且不连续:ROX添加不当。需校正参比染料。
Q3:标准曲线扩增效率小于90%或者大于120%,线性关系不佳。
A3:(1) 加样误差。加大模板稀释倍数,提高加样体积。加大稀释体积,使不同稀释梯度的浓度更准确。
(2) 标准品降解。重新制备标准品,重复实验。
(3) 模板浓度过高。存在反应抑制,增加模板稀释倍数。
(4) 引物扩增特异性不好。重新设计引物,重复实验
Q4:在定量时,如何判断cDNA投入量。
A4:首次得到的cDNA需要进行多个梯度稀释,将不同梯度稀释的cDNA进行qPCR定量,选取CT值落在18-28,或者15-33范围内的扩增曲线对应的cDNA 稀释梯度作为后续该基因的参考稀释度(CT值在18-28,或者15-33区间范围被认为是准确的)。有一点需要注意,当使用cDNA原液进行检测的时候,使用量不能超过 qPCR体系的1/10,因为cDNA中包含很多抑制qPCR的组份,使用体积过大会导致扩增失败。
Q5:如何确定基因表达量高低。
A5:如果基因扩增CT值超过30,使用PCR产物通过梯度稀释创建标准曲线,判断该引物扩增效率,若扩增效率满足90-120%,则可以判断该基因扩增CT值偏大是由于基因表达量低所致。
Q6:阴性对照出现明显扩增。
A6:(1) 反应体系污染。更换新的Mix、水、引物重复实验。反应体系在超净工作台内配制,减少气溶胶污染。
(2) 扩增为引物二聚体引起。配合熔解曲线进行分析。
Q7:NRT出现明显扩增。
A7:NRT出现明显扩增,说明存在基因组污染,可通过实验组和NRT的CT值来判断实验数据是否可用。当实验组CT值与NRT的CT值差值大于5,说明由gDNA导致的误差小于5%,则可以忽略gDNA污染;若实验组与NRT的CT值差值小于3或者几乎一致,则实验组扩增产物的模板很大一部分来源于gDNA,这样的实验组就失去定量意义,建议使用去基因组的RNA提取试剂盒进行RNA提取,或者反转录时,加入去基因组步骤。
Q8:CT值出现太晚。
A8:(1) 扩增效率极低。优化反应条件,尝试三步法扩增程序,或者重新设计合成引物。
(2) 模板浓度太低。减少稀释度重复实验,一般未知浓度的样品先从最高浓度做起。
(3) 模板降解。重新制备模板,重复实验。
(4) PCR产物太长。推荐PCR产物长度为80 bp-150 bp。
(5) 体系中存在PCR抑制剂。一般为模板带入,加大模板稀释倍数或者重新制备模板重复实验。
Q9:反应结束无扩增曲线出现。
A9:(1) 反应循环数不够。一般设置循环数为40,但需要注意的是过多的循环会增加过多的背景信号,降低数据可信度。
(2) 确认程序中是否设置了信号采集步骤。两部法扩增程序一般将信号采集设置在退火延伸阶段;三步法扩增程序应当将信号采集设置在72℃延伸阶段。
(3) 确认引物是否降解。长时间未使用的引物应先通过PAGE电泳检测完整性,以排除引物降解的可能性。
(4) 模板浓度太低。减少稀释度重复实验,一般未知浓度的样品先从最高浓度做起。
(5) 模板降解。重新制备模板,重复实验。
Q10:熔解曲线出现多峰。
A10:(1) 引物设计不优。根据qPCR设计原则设计、合成新的引物。
(2) 引物浓度太高。适当降低引物浓度。
(3) cDNA模板带有基因组污染。重新制备cDNA模板。
Q11:实验重复性差。
A11:(1) 加样体积失准。使用准确度较好的移液枪,扩大反应体积,将模板做高倍稀释,以大体积加入反应体系中。
(2) 定量PCR仪不同位置温度控制不一致。定期校准仪器。
(3) 模板浓度太低。模板浓度越稀,重复性越差,减少模板稀释度或提高加样体积。
(4) 做4-6个复孔,删除其中重复性不好的孔,将剩余的进行后续计算。
Q12:如果内参CT值很低,目标基因CT值很高,该如何稀释样品?
A12:可以在定量内参的时候将模板稀释,而定量目的基因时模板不稀释,结果仍旧采用 2-ΔΔCT进行计算,CT值减两次,稀释倍数会被相应减掉,但要保证不同样品在检测同一基因时稀释倍数要一致。
Q13:如何预防气溶胶污染?
A13:在加样的时候要小心操作,尽量在超净工作台中进行加样,并注意通风。扩增反应结束后,尽量不要打开产物的管盖,不要跑胶,跑完后需要妥善处理。如果气溶胶污染情况很严重,建议采用通风结合含强氧化剂的消毒液进行处理。
Q14:相对定量为什么要做标准曲线?
A14:相对定量分析中采用2-ΔΔCT公式进行计算比较不同样品中基因的表达量时,前提是该体系的扩增效率e是尽可能接100%的。相对定量中做标准曲线的目的就是为了判断该扩增体系中的扩增效率e是否是接近100%,能否用2-ΔΔCT公式进行计算;如果扩增效率e与100%相差很大,在比较基因表达差异时是需要带入实际的扩增效率进行计算的。
Q15:怎么做绝对定量?
A15:首先需要有一个已知拷贝数浓度的样品作为标准品,将其稀释至少5个梯度后和待测样品同时上机进行定量检测,以标准品拷贝数的Log值为横坐标,以标准品的CT值为纵坐标绘制标准曲线方程,将检测获得的待测样品的CT值带入标准曲线方程中就能求得待测样品的拷贝数浓度。
相关产品





