HA Tag Mouse mAb
N端C端随心意,用于WB、IF和IP

免疫印迹(western blotting); 免疫沉淀(immunoprecipitation); 免疫荧光(immunofluorescence)

- 特异性好
- 灵敏度高
- 稳定性强
- 应用广泛

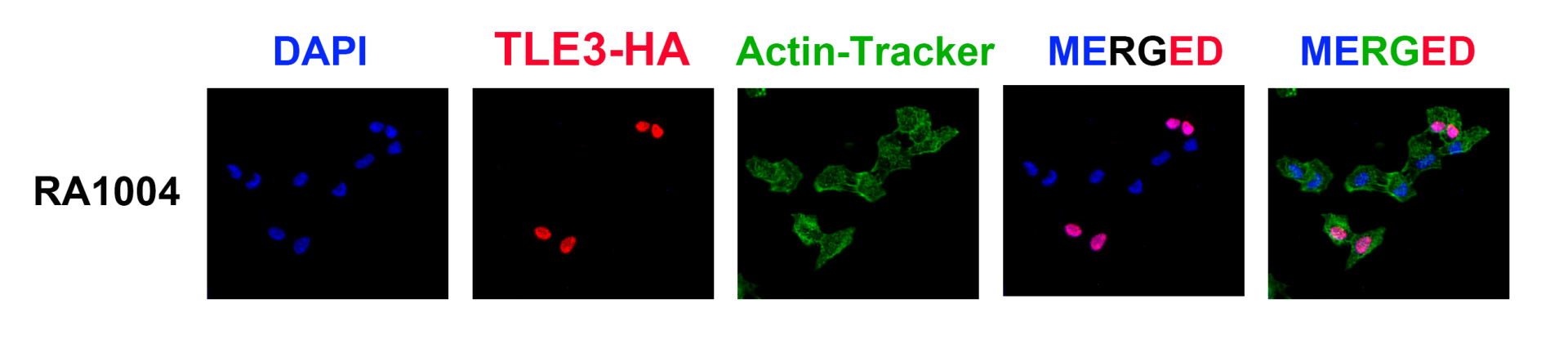
本产品为小鼠来源的单克隆抗体,能够结合与目的蛋白融合的HA标签。该标签由9个氨基酸组成(氨基酸序列为YPYDVPDYA),分子量为1.1 kDa,一般融合到靶标蛋白的氨基(N端)或羧基(C端)末端,对目的蛋白的空间影响较小。此抗体可识别融合蛋白N端和C端的HA多肽序列,适用于WB、IP和IF实验。

1. 特异性好
RA1004能稳定识别N端和C端的融合标签,特异性也优于同类产品。
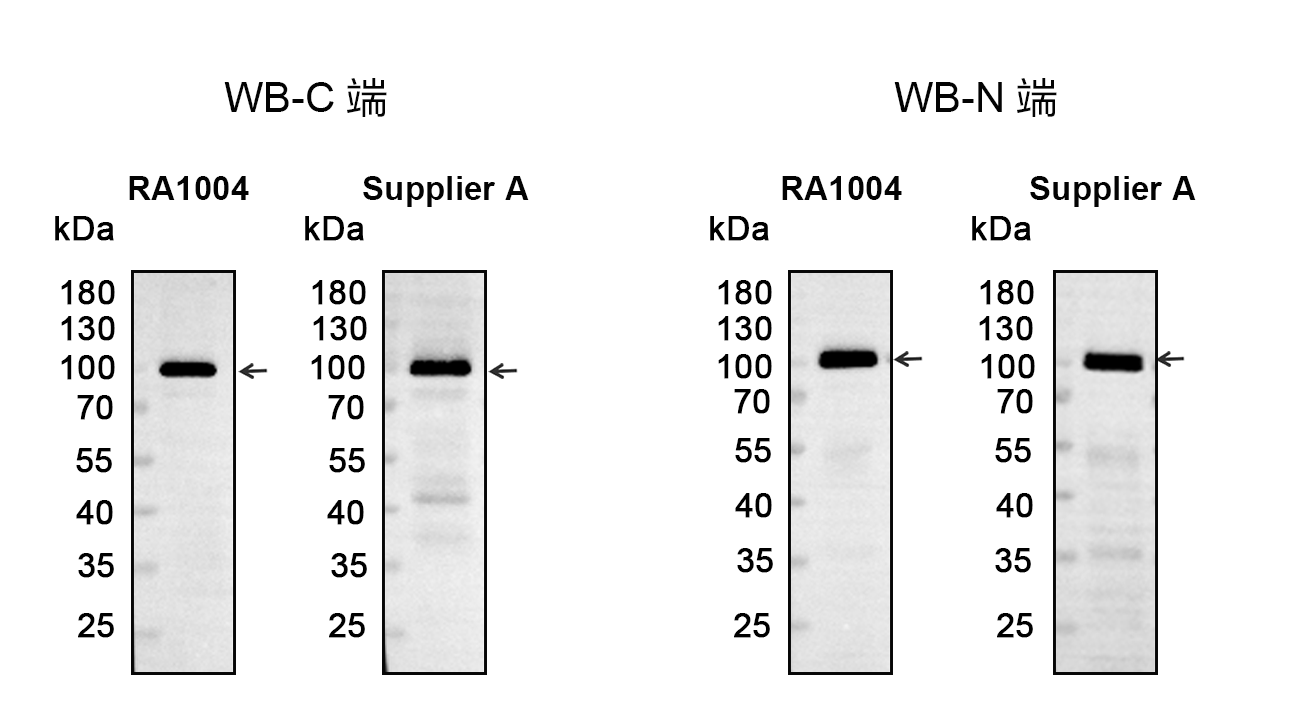
2. 灵敏度高
293细胞过表达样本在总蛋白上样量低至2 μg时,仍能检测到目的蛋白。
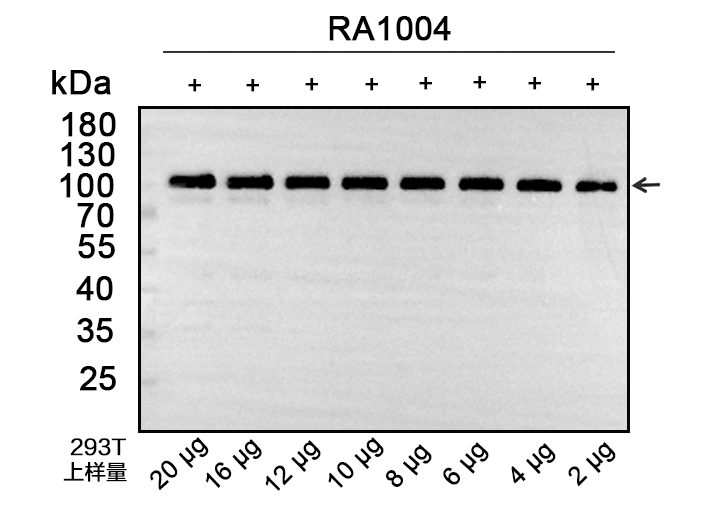
3. 稳定性强
37℃存放 7 天、冻融 14 次仍保持良好性能。
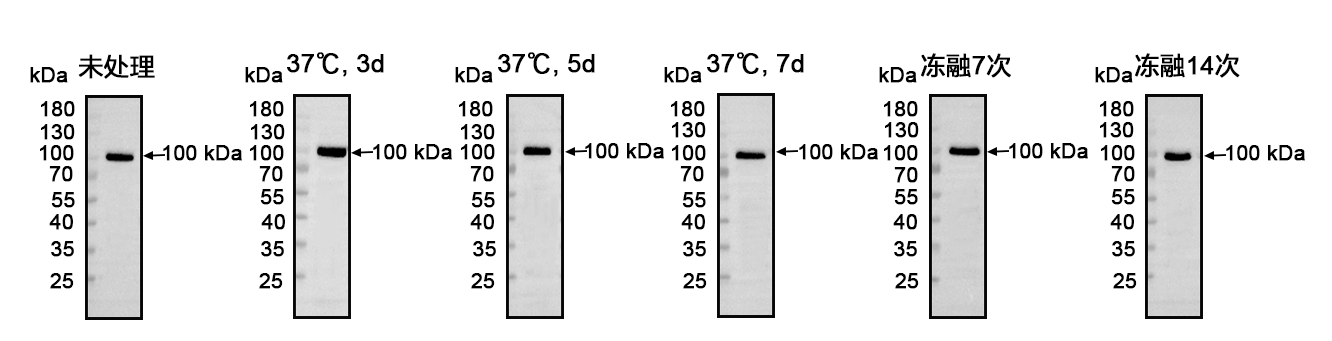
4. 应用广泛
免疫沉淀及免疫荧光同样表现稳定。
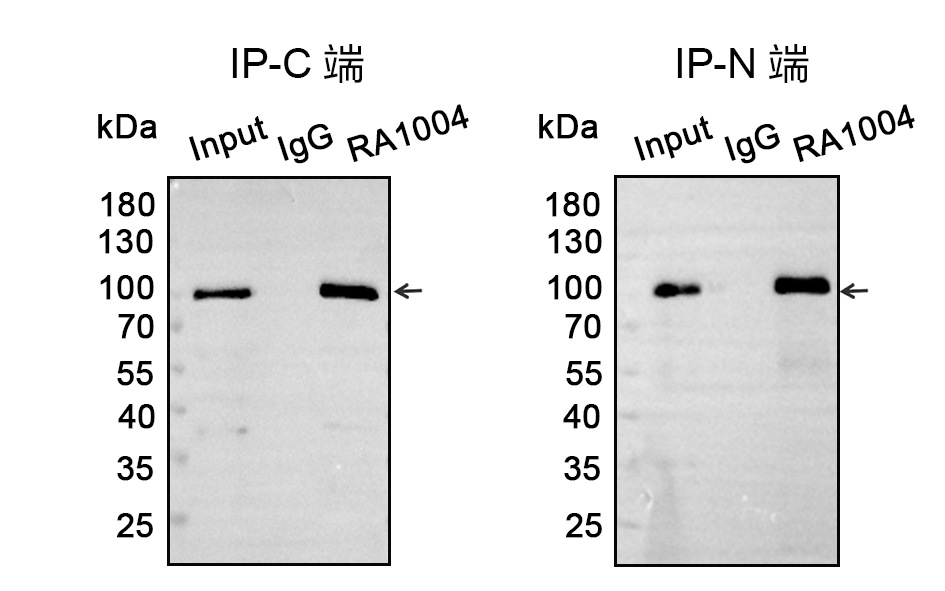



-30 ~ -15℃保存
Q1:WB未检测到融合蛋白
A1:(1) 蛋白未表达:验证所构建的载体中标签融合蛋白的核酸序列和阅读框。
(2) 目的蛋白表达量低:设置阳性对照,如果阳性对照正常,样品可能不含标签融合蛋白,或者含量太低无法检测。低浓度融合蛋白可能需要通过免疫沉淀检测。
(3) 抗体失效:设置阳性对照,如果对照组未获得信号,则重新稀释或更换一抗/二抗重复该过程。
(4) 曝光时间不足:如果没有观察到信号,适当延长曝光时间。建议尝试5秒至10分钟的曝光时间。
(5) 转膜失败:参照预染marker确定转膜时间,转膜后可用丽春红染色观察。
(6) 封闭过度:如果封闭液浓度过高,则可能发生信号掩蔽。建议进行1:1至1:3的稀释比降低阻断剂的浓度。如果问题仍然存在,请使用TBS和3%脱脂牛奶。
(7) 抗体浓度太低/过高:设置预实验,建议优化抗体浓度。
(8) 过度洗膜:蛋白结合不牢靠,洗涤液效果太强,更换洗涤液;或预实验优化洗膜时间和次数。
(9) 一抗二抗不匹配:根据一抗种属选择合适的二抗。
(10) 显色液失效:显色液现配现用;所用溶液和容器中避免含有叠氮钠。
(11) 细胞裂解不充分:建议进行超声处理,以确保充分裂解,增加蛋白回收率,超声处理后,对样品进行离心,收集上清液用于进行检测。
Q2:WB背景高
A2:(1) 蛋白含量过高:减少蛋白上样量或稀释蛋白样本液
(2) 抗体浓度过高:建议适当增加标签抗体稀释倍数。
(3) 二抗交叉反应:建议适当增加二抗稀释倍数。
(4) 标签抗体与天然存在的类似标签蛋白表位发生交叉反应:在封闭、抗体孵育和洗膜步骤中将温度升高至37℃可能会降低交叉反应性。设置转染对照(用非重组质粒转染)的裂解物有助于区分标签融合蛋白和其他交叉反应蛋白。
(5) 洗膜不充分:少量多次洗涤;适当增加洗涤剂强度,如Tween-20换成NP-40。
(6) 过程中膜干燥:全程保持膜湿润。
(7) 封闭不充分/封闭液选择出错:延长封闭时间;增加封闭蛋白浓度;更换封闭液,如BSA。
Q3:WB条带异常
A3:(1) 微笑条带,电泳温度过高:降低迁移速度或低温电泳(置于冰上)。
(2) 条带拖尾(糖基化蛋白/裂解不完全):糖基化蛋白:不同的糖基化通常导致在分子量高于预测的分子量处产生条带拖尾效应,建议样本使用 PNGase F处理;裂解不完全:建议进行超声处理。
(3) 条带偏斜,电极不平衡或者加样位置偏斜:调整电泳仪器;缓慢平稳加样。
(4) 条带两边扩散,样品中盐离子浓度过高:重新制备样本,去除盐离子干扰。
(5) 暗片白条带,一抗或二抗加入过多:适当稀释抗体浓度。
Q4:IP背景高
A4:(1) 非特异性蛋白质与珠子结合:珠子用BSA预封闭不充分,确保BSA新鲜,新鲜珠子与含1%BSA的PBS孵育1小时,之后用PBS洗3-4次。
(2) 抗体浓度过高:检查推荐抗体用量;适度降低抗体添加量。
(3) 免疫沉淀实验时抗原降解:确保样品裂解时加入新鲜的蛋白酶抑制剂。
(4) 抗体特异性不够:使用亲和纯化的抗体。
Q5:IP无信号或条带很弱
A5:(1) 显影液失效:通过检查显影液清澈度初判,并通过立即更换新显影液后再曝。
(2) 底物失效:TBST润洗膜几次,重新加合格的底物。
(3) 二抗浓度过高或孵育时间过长:降低二抗浓度;减少孵育时间。
(4) 目标蛋白没有从珠子上洗脱:确保洗脱缓冲液是洗脱蛋白质所需的正确强度及正确pH值。
(5) 抗体未与珠子结合:确保使用的珠子与抗体亚型匹配。
(6) 表位掩蔽:尝试一种识别靶标蛋白不同区域内表位的抗体。
Q6:IP条带正确,但显影过强或过弱
A6:(1) 目的蛋白或抗体用量过大:可减少上样量、提高一抗稀释度并缩短曝光时间。
(2) 目的蛋白或抗体用量过小:可增加上样量、降低一抗稀释度并延长曝光时间。
Q7:Input泳道无目的带,而IP泳道有
A7:目的蛋白丰度不高,无法直接通过WB检出,而 IP 能进行浓缩富集
Q8:Input泳道有目的带,而IP泳道无
A8:(1) 该种一抗主要识别和结合靶蛋白内部的线性表位、而非暴露在外表的的线性或空间表位,故IP制样时无法有效捕获住组织或细胞中的天然结构靶蛋白。
(2) 抗体亲和力低。一般而言,相比于WB,IP实验需要更高亲和力的抗体。
Q9:轻重链干扰
A9:用于IP的一抗的变性IgG轻链和重链在蛋白质印迹物上分别定位在约25kDa和50kDa处,可能掩盖分子量相似的靶蛋白条带:IP和WB分别选用种属来源不同的一抗;可以使用轻链特异性二抗;选用构象二抗。
Q10:IF信号弱或无信号
A10:(1) 封闭时间过长:封闭时间应保持常温1 h左右,或者4℃过夜。
(2) 抗体浓度过低;孵育时间较短;孵育温度不当:根据预实验,适当提高抗体浓度;优化孵育时间;常温孵育时间1-2 h,过夜孵育应置于4℃冰箱内。
(3) 缓冲液残留较多,间接稀释抗体浓度:洗片后的缓冲液应尽量沥干。
(4) 滤光片选择不合适:更换滤光片。
(5) 样品保存不当,如果荧光团暴露于光线下的时间过长,可能会导致信号衰减:在避光条件下进行孵育和样品储存,可将样品封装于抗淬灭试剂中。封片后要立即对样品进行成像。
(6) 细胞/组织样品不新鲜:使用新鲜制备的载破片/板,以避免丧失抗原性。
(7) 目的蛋白未表达或表达较低:针对每种靶标确定合适的处理条件和对照,考虑放大信号,或与更亮的荧光团配对。
(8) 通透方法错误:查阅说明书以了解建议的实验步骤。
(9) 二抗使用不正确:按建议浓度使用,并检查二抗是否与一抗的宿主相匹配。
(10) 激发波长错误:确保照射和检测(激光/激发/发射滤光片)与一个或多个荧光团的激发波长相匹配。
Q11:IF染色深
A11:(1) 封闭时间过短:封闭时间应保持常温1 h左右,或者4℃过夜,可适当提高封闭液浓度。
(2) 抗体浓度过高或者孵育时间过长:降低抗体浓度,抗体孵育时间:室温1-2 h或者4℃过夜。
(3) 洗涤不充分:根据预实验,适当增加缓冲液洗涤次数和时间。
(4) 样品自发荧光:以未经染色的样品为对照,检测自发荧光程度,对于低丰度靶标,选择较长的波长通道。
(5) 样品变干:在整个染色过程中始终保持样品处于液体中。
(6) 二抗交叉反应性:使用同型对照抗体,以确定你的二抗是否发生交叉反应。
(7) 非特异性抗体结合:如可能,请与敲低 (siRNA) 或敲除细胞进行比较,或与已知表达靶抗原的水平较高或较低的细胞进行比较。
Q12:IF信号位置错误
A12:(1) 组织细胞中未表达抗原:设立阳性对照,以验证实验结果;换其他组织细胞检测。
(2) 固定方法不当:固定试剂大体可分为交联固定剂和可溶性溶剂固定剂,尝试换不同类的固定剂处理抗原样品。
相关产品





