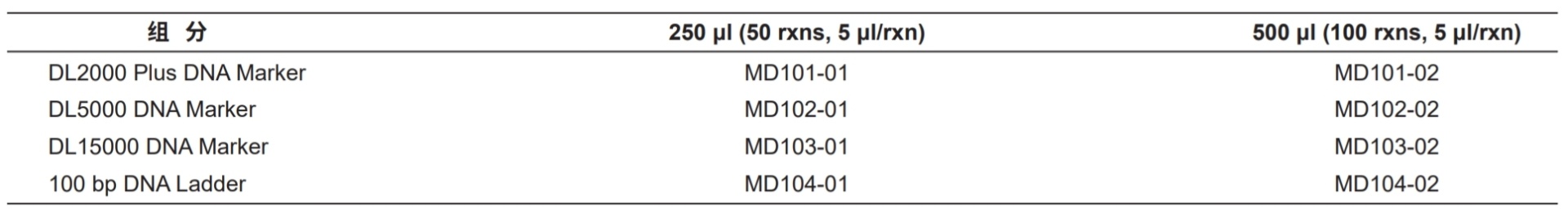
DNA Marker/Ladder
稳定、清晰、准确的DNA 分子量Marker

琼脂糖凝胶电泳;DNA分子量标准

· 稳定性好:室温可存放6 个月,所有条带清晰、致密
· 操作简便:即用型产品,跑胶时可直接取适量本产品进行电泳
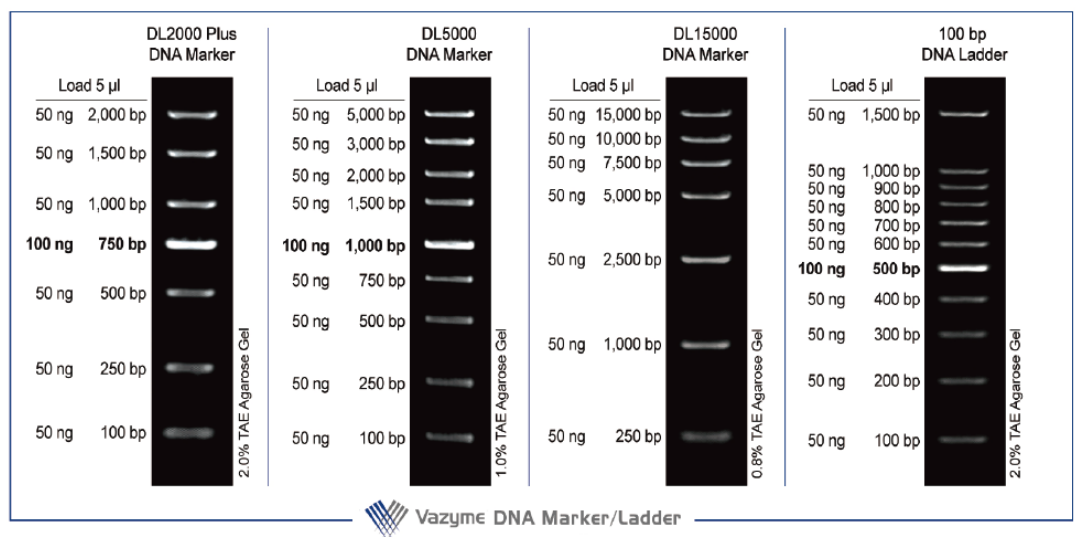

DNA Marker/Ladder 由特定分子量的双链DNA 片段组成,已混有含蓝色染料的上样缓冲液,适用于琼脂糖凝胶电泳时作为DNA 分子量标准。DNA Marker/Ladder 中所有片段均由质粒经酶切、纯化后获得,电泳时Marker/Ladder 的条带更加清晰、致密;条带之间的质量比更准确、真实。DL2000 Plus DNA Marker 中的750 bp 片段、DL5000 DNA Marker 中的1,000 bp 片段、100 bp DNA Ladder 中的500 bp 片段以及1 kb DNA Ladder 中的5 kb 片段的DNA 浓度为100 ng/5 μl,显示亮带;其余所有条带的DNA 浓度为50 ng/5 μl。


-20℃保存;融化后于4℃保存,避免反复冻融。
上一页
Q1:Marker跑胶拖带或跑不开
A1:(1)电压:按照推荐的电泳条件,1 × TAE缓冲液,0.8% - 2.0%琼脂糖凝胶,正负极之间电压4 - 10 V/cm(常规电泳仪建议180V电压)跑胶;
(2)染料类型:如果大分子染料建议使用泡染法或者预混法;
(3)琼脂糖凝胶:
①建议在溶胶时使琼脂糖颗粒全部溶解,若使用微波炉加热进行溶解,可以让液体沸腾2-3次;
②确保胶充分冷却凝结,30-60min为宜,如果不能及时使用,要放在TAB/TBE液体中保存;
(4)试剂保存条件:放在4度保存,避免反复冻融。
Q2:Marker的条带亮度问题
A2:(1)每条亮度都一样:若使用泡染法,可能是泡染的时间太长或太短,需要根据情况摸索调整时间;
(2)仅底部两条带亮:条带降解导致;
(3)亮度很弱:
①上样量小于5ul会导致条带很暗;
②制胶时琼脂糖颗粒未完全溶解或者凝固后不均匀。
Q3:Marker条带缺失
A3:(1)条带重叠:延长跑胶时间,适当提高电压;
(2)小条带跑出胶或丢失:降低电压缩短跑胶时间。使用EB作为核酸染料时,由于EB与DNA的结合力较弱,且EB与DNA的电泳方向相反。电泳时间较长时,DNA条带跑到前面,EB就可能与DNA脱离,从而使条带变弱。因此电泳时将溴酚蓝跑到凝胶2/3处即可停止电泳;
(3)EB添加量低。
Q4:Marker条带模糊
A4:(1)Marker条带出现降解:请确保在使用过程中避免核酸酶污染;
(2)电泳缓冲液陈旧:电泳缓冲也多次使用后,离子浓度降低,ph值上升,缓冲能力减弱,从而影响电泳效果,建议经常更换电泳缓冲液;
(3)电泳条件不合适:电泳时电压应不超过20V/cm,温度应低于30℃。
Q5:Marker条带不规则,如哑铃型或波浪形
A5:(1)电泳缓冲液陈旧:老化的电泳缓冲液离子浓度降低,ph值上升,缓冲能力减弱,从而影响电泳效果,建议经常更换电泳缓冲液;
(2)电泳条件不合适:电泳时电压最高不应超过20V/cm,电压太高可能也会导致Marker条带出现不规则现象;
(3)凝胶质量差以及凝胶冷却时凝固不均匀。
Q6:Marker条带弯曲
A6:(1)电压过高或电压不稳;
(2)如果使用大分子染料,建议使用泡染法或者预混法;
(3)Marker加在胶两端的孔容易出现条带弯曲;
(4)更换新鲜的缓冲液。
(5)琼脂糖颗粒未完全溶解或凝胶时间过短,30-60min为宜。
Q7:能不能用作聚丙烯酰胺凝胶电泳Marker?
A7:不适用于聚丙烯酰胺凝胶电泳。
上一页
相关产品
Phanta Max Super-Fidelity DNA Polymerase
P505-d1/d2/d3
P515-01/02/03





