Mouse CD4+ T Cell Isolation Kit
小鼠CD4+ T细胞分选试剂盒
磁分细选,纯净无杂

小鼠CD4+ T细胞分离纯化

Vazyme小鼠CD4+ T细胞分选试剂盒可以从小鼠淋巴结、脾脏及其混合样本中分离、纯化CD4+T细胞。试剂盒使用阴性选择的方法,通过磁珠和 Streptavidin-Biotin系统去除非目的细胞,可以在16 min左右快速得到高纯度、高活性、无磁珠标记的目的细胞。
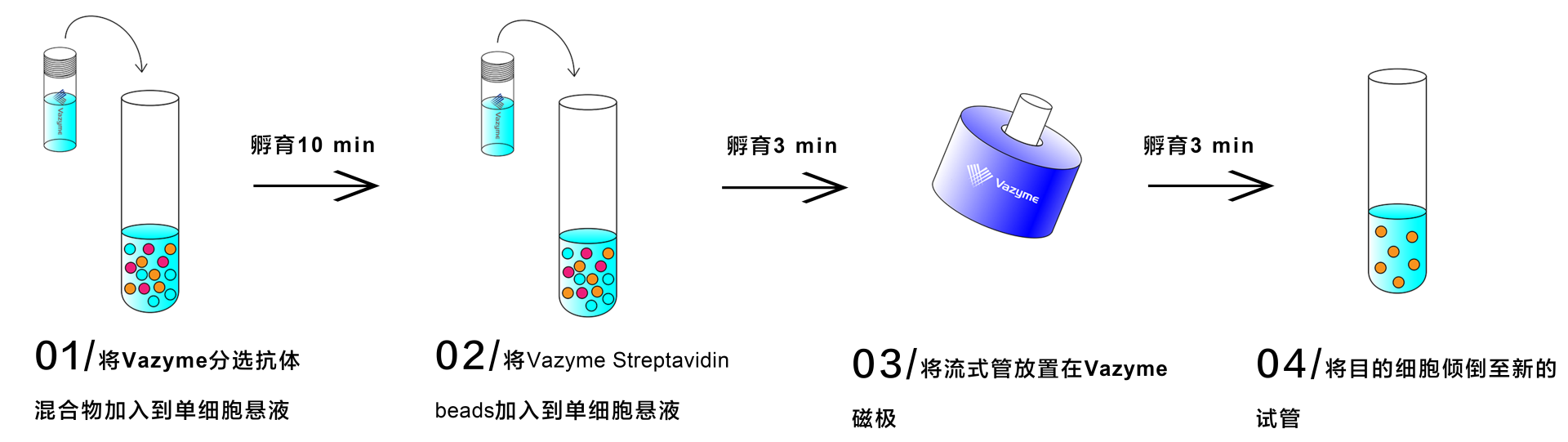
图 1 T细胞分选操作流程

纯度高:分选细胞的纯度可高达96%-99%
活性好:阴性选择,磁珠不与细胞直接接触
速度快:无需分离柱,16 min即可获得目的细胞
无刺激:分选后细胞无异常激活,不影响下游实验

1.分选纯度高,得率高
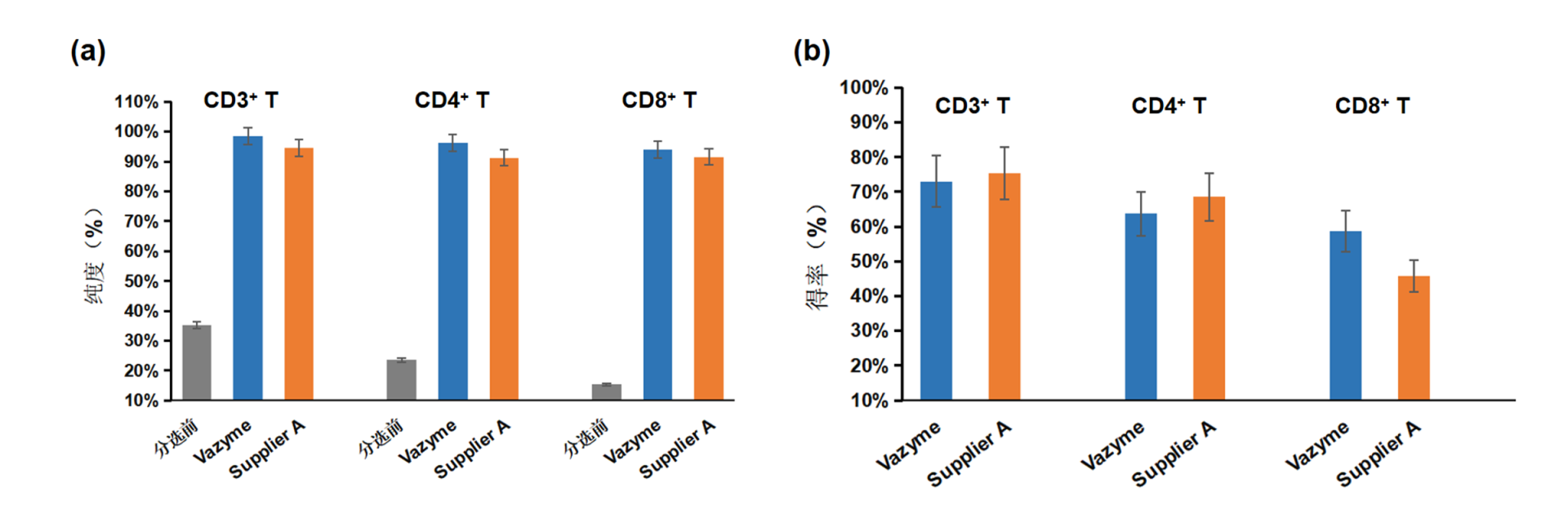
图 2 Vazyme 细胞分选试剂盒纯度和得率测试结果
使用 Vazyme 细胞分选试剂盒进行阴性选择获得的目的细胞有较高的纯度(图a)和得率(图b)。
2.细胞活性高,样本兼容广
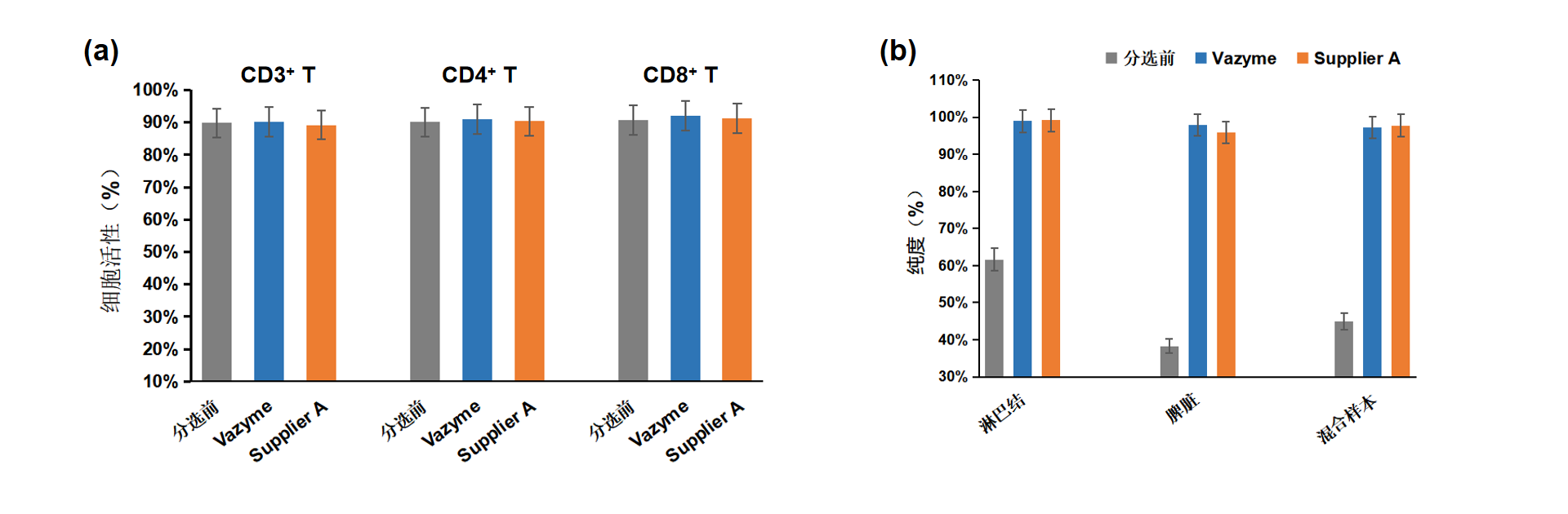
图 3 Vazyme 细胞分选试剂盒分选后细胞活性检测(a)以及样本兼容性检测(b)
使用 SYTOX对分选前后的样本进行染色,相对于分选前细胞而言,使用 Vazyme T细胞分选试剂盒分离的细胞,活性基本保持不变(图a)。此外,Vazyme T细胞分选试剂盒可以兼容脾脏、淋巴结及其混合样本(图b)。



2 ~ 8℃保存,切勿冷冻
Q1:分选纯度低
A1:
(1)死细胞过多。制备单细胞悬液时,应尽量轻轻研磨样本,避免细胞破损。可用台盼蓝染色判断细胞状态;
(2)红细胞裂解不充分。建议适当增加裂解液使用量或延长裂解时间;
(3)初始细胞量或细胞浓度过高/低。本产品分选细胞数量为1 × 107-2 × 108 cells,进行分选前应使用细胞计数仪或流式细胞仪进行细胞数目测定。试验中细胞浓度应调整为(1 × 108 cells)/ml;
(4)产品组分未充分混匀。Isolation Cocktail 和 Streptavidin Beads添加后应充分吸打混匀,其中Streptavidin Beads组分容易沉降,可以每1 - 2 min应吸打混匀1次;
(5)抗体的使用量或孵育时间不足。应按照说明书推荐抗体使用量和时间进行冰上孵育;
(6)染色异常。建议使用说明书推荐的抗体染色,避光条件下,冰上孵育30 min或室温15 min。
Q2:分选得率低
A2:
(1)计算方式不恰当。得率=(分选后细胞数×分选后目的细胞纯度)/(分选前细胞数×分选前目的细胞纯度);
(2)Streptavidin Beads孵育时间过长。建议按照说明书推荐时间进行孵育。 Streptavidin Beads孵育时间过长可能会导致非特异性吸附;
(3)分选体积不恰当。按照分选柱建议的上样量,建议细胞浓度为1 × 108 cells/ml;
(4)细胞悬液含有细胞团块。磁珠分选之前应该过滤去除细胞团块;
(5)抗体或磁珠用量超过说明书建议用量。按照说明书推荐的抗体/磁珠用量进行分选。
Q3:分选活性低
A3:
(1)样本制备研磨过于剧烈。制备单细胞悬液时,使用针管的针栓横截面进行研磨,应尽量轻轻研磨样本,避免细胞破损,分选前可以使用台盼蓝染色,确定细胞活性;
(2)分选过程造成机械损伤。分选过程应尽量保持动作轻柔,避免造成过大的机械损伤;
(3)分选时间过长。制备单细胞悬液后,尽快进行细胞分选,时间越长,细胞死亡越多;
(4)分选温度过高。分选细胞收集后需贮藏在适当温度下,一般是保存在4度或者冰上;
(5)细胞裂红体积过大或者时间过长。减少细胞的裂红体积或者裂红时间。
Q4:分选结果存在高背景或非特异染色
A4:
(1)荧光染料孵育时间过长。荧光染料孵育时间可参照说明书推荐的使用时间;
(2)分选buffer成分影响目的抗原。需检查分选buffer成分;
(3)含细胞粘连体或死细胞。在进行活细胞表面染色时,使用活细胞鉴定染料对死细胞设门;使用时确保细胞样本新鲜,细胞尽量都放在冰上操作;
(4)分选buffer不新鲜。使用的分选buffer,请确认分选buffer新鲜并且已经正确制备;
Q5:分选结果无染色或弱染色
A5:
(1)细胞群的设门不正确。对细胞群进行正确的设门;
(2)荧光染料淬灭。荧光抗体及荧光抗体染色后的样本需注意避光保存;
(3)荧光抗体过期或未按照正确温度条件贮藏。需确认抗体储存温度,保质期;
(4)染色细胞数量过多。可以调整细胞群至推荐的密度,如5 × 105 cells添加0.5 μl检测抗体,避光条件下,冰上孵育30 min或室温15 min。
相关产品
Mouse CD3+ T Cell Isolation Kit
CS101-01
Mouse CD8+ T Cell Isolation Kit
CS103-01





