VAHTS Serum/Plasma Circulating DNA Kit
血浆/血清等无细胞体液样本高质量游离DNA提取

游离DNA提取;产物可用于qPCR;二代测序;文库构建

兼容:兼容无游离醛基的cfDNA采血管如Streck Cell-Free DNA BCT或VAHTS游离DNA保存用采血管或普通EDTA采血管采集样本
高产:提取产量高,目的小片段占比高
通用:适用于手动提取以及自动化提取程序
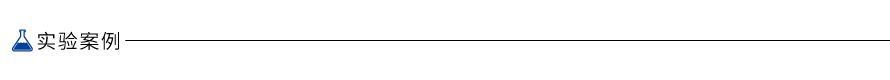
1.适用于短片段cfDNA提取
人cfDNA为平均长度180 bp的短片段DNA,因此对较小的DNA片段回收率是评价cfDNA提取效率的关键因素。使用VATHS磁珠法血浆游离DNA提取试剂盒中的磁珠提取DNA ladder(70-1000 bp区间),与原始DNA以相同稀释倍数经Agilent 2100 DNA1000芯片检测如右图所示,提取后的DNA与投入DNA重合度高,基本无DNA片段大小偏好性。
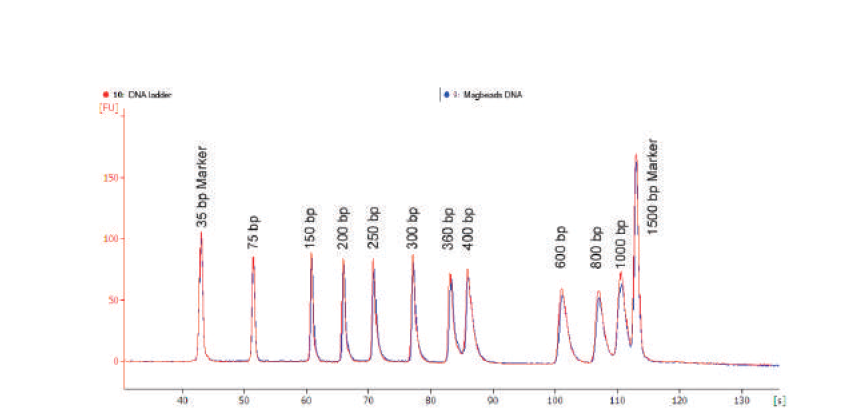
2.提取纯度高
使用VAHTS磁珠法血浆游离DNA提取试剂盒提取血浆cfDNA,经Agilent 2100高敏芯片检测,线条平滑,cfDNA峰型饱满,其它位置无杂峰,显示提取的cfDNA纯度高,杂质少。使用提取的cfDNA进行用于二代测序的建库实验,建库产量高,无杂峰,更适用于二代测序检测。
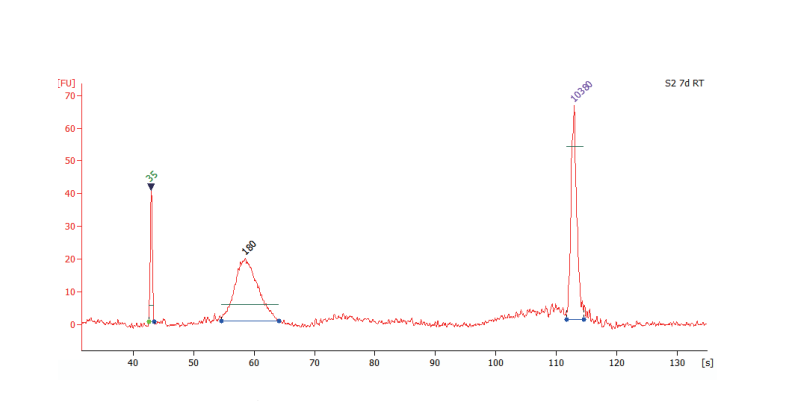
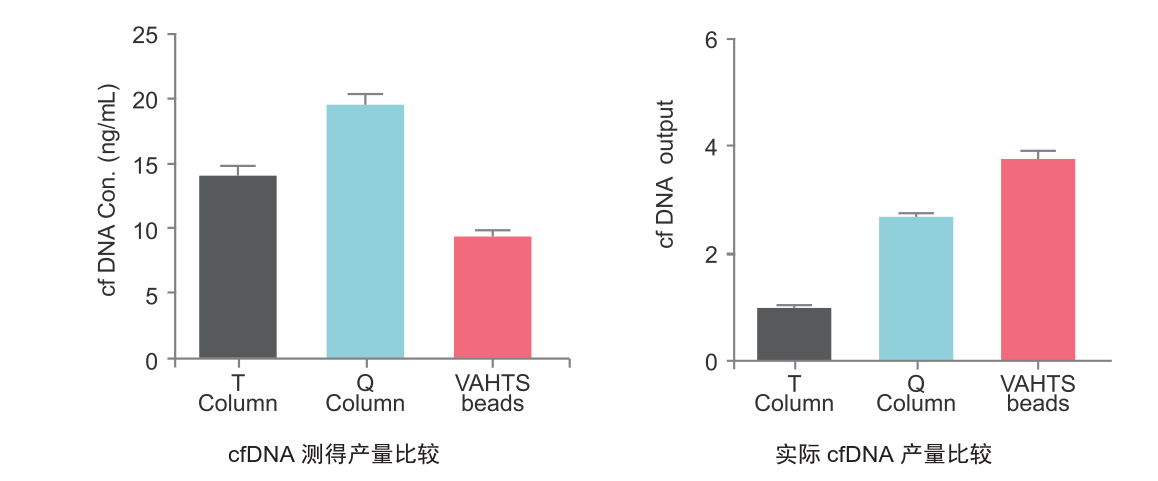
3.提取产量高
与进口柱纯化游离DNA提取kit(Q)和国产柱纯化游离DNA提取kit(T)提取同一血浆样本的游离DNA,经Qubit试剂盒(Thermo Fisher)测定浓度,VAHTS 磁珠提取产量少于Q及T柱纯化产物,但经qPCR检测血浆中掺入的痕量短片段外源DNA相对投入量的比例,VAHTS磁珠提取的产量是Q柱纯化的1.5倍左右,T柱纯化的3倍以上,说明受Carrier RNA影响,通过Qubit测定的浓度不能反映实际cfDNA浓度,VAHTS磁珠法提取试剂盒实际提取效率高于传统柱纯化方式。
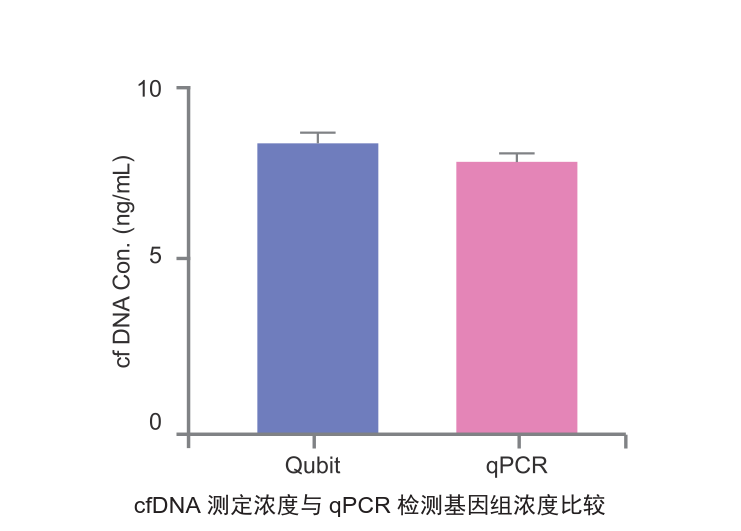
4.提取DNA浓度准确
传统柱纯化法受到Carrier RNA加入的影响,测定浓度时比实际值偏大,影响后续操作判断。VAHTS磁珠法提取的cfDNA浓度准确,用Qubit试剂盒定量及用KAPA gDNA绝对定量试剂盒(KAPA hgDNA Quantification and QC Kit)做QPCR的定量结果吻合度高。
5.兼容手动提取及自动提取程序
手动提取最大样本量可达16样/次,操作时间<2小时/次。由于磁珠法无需离心换管等操作,因此同样可适用于目前主流的自动核酸提取仪如KingFisher Flex Smart32游离DNA提取仪,可针对不同样品量及样品来源设定不同处理程度,简单、快速的进行大规模提取,大大降低实验者的工作量和实验中的人为误差,保证结果的稳定性和均一性。
6.cfDNA构建文库覆盖度好,无GC偏好性
使用VAHTS磁珠法血浆游离DNA提取试剂盒提取cfDNA,1ng投入建库进行测序分析。测序平台为X-Ten,cfDNA PCR文库测序数据显示GC含量正常,没有偏好性;Q30在90%以上,说明测序数据质量较好;因cfDNA属于高度片段化状态,覆盖度在60-70%,属于正常范围;dup rate普遍较高,和测序平台有关;数据显示几乎没有接头残留。

本试剂盒基于超顺磁性的磁珠纯化技术,针对从200 μl-2 ml的血清、血浆等无细胞体液样品中提取高质量短片段游离DNA定向优化的DNA提取试剂盒,具有DNA提取无偏好性、提取效率高、核酸纯度高、重复性强等优点。本试剂盒操作简单、快速,全程无有毒有机溶剂,得到的DNA可直接用于定量PCR和二代测序等下游常规实验。兼容手动提取和自动提取流程,同时兼容无游离醛基的cfDNA采血管如Streck Cell-Free DNA BCT或VAHTS游离DNA保存用采血管或普通EDTA采血管得到的血浆样本。



Box1,2-8℃保存;溶解后的 Proteinase K须保存于-20℃。
Box2,室温保存。
下一页
Q1:使用N902提取的产物中有白色絮状沉淀是怎么回事?
A1:可能是4度保存的PK活性下降,导致蛋白去除不干净,形成白色絮状沉淀。建议不再使用,更换新的试剂。
Q2:蛋白激酶K干粉和溶解后分别怎么保存?能否将蛋白激酶k溶解后保存在4°?
A2:干粉2-8°保存,溶解后-20°保存。溶解后的酶不能保存在4℃,否则可能会有所降解;适当的解冻次数不影响,实在担心可以进行分装。
Q3:N902提取的方法是磁珠法还是柱提法?
A3:采用的是磁珠法进行提取。
下一页
相关产品
N411-01/02/03





