TUNEL BrightGreen Apoptosis Detection Kit
更亮、更稳定的绿色荧光 TUNEL 凋亡检测

石蜡切片、冰冻切片、贴壁和悬浮培养细胞的凋亡检测

Bright 因子,使得荧光更亮,抗淬灭能力更强
高活性的重组TdT 酶保证荧光掺入效率
适用于细胞爬片、石蜡切片和冰冻切片
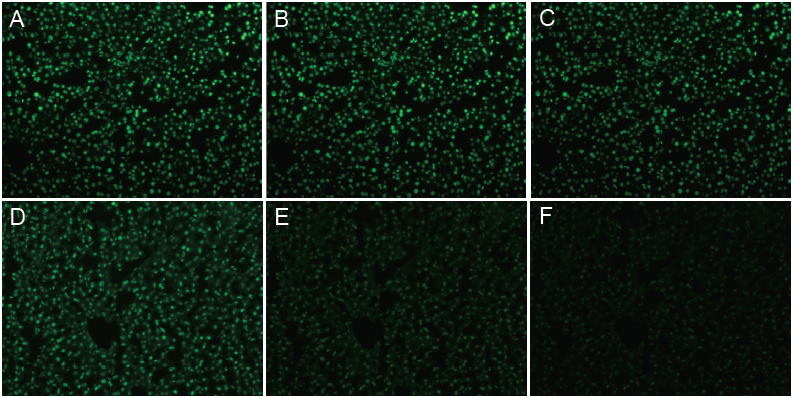
图1. 小鼠肝脏组织
组织切片经DNase I 处理后TUNEL 染色。A-C 分别为BrightGreen 染色后于紫外光(460 nm) 下照射1 min、3 min、6 min 后拍照。D-F 分别为FITC 染色后于紫外光(460 nm) 下照射1 min、3 min、6 min 后拍照。

TUNEL BrightGreen Apoptosis Detection Kit 是TUNEL FITC Apoptosis Detection Kit (A111) 的升级版本。试剂盒中包含小分子化合物Bright 因子,可与FITC 非共价结合,增强其稳定性,并使其信号放大,从而使标记物更亮,抗淬灭能力更强。


-30 ~ -15℃保存,≤0℃运输;
BrightGreen Labeling Mix:-30 ~ -15℃避光保存。
Q1:TUNEL实验的注意事项。
A1:(1)样本:如果样本是细胞,注意尽量制作成细胞爬片进行TUNEL实验,能够有效的降低背景;如果样本是切片,注意切片制作过程中一定要固定,固定时间在24-36 h。需要预先观察切片或细胞是否带有自发荧光;
(2)对照组设置,为了方便排查原因,每次实验请带上TUNEL阳性对照与阴性对照;
(3)固定:选择4%多聚甲醛作固定液,乙醇、甲醇、酸性固定液,会导致标记效率低;固定时间不宜过长,过长导致交联程度过高,进而降低标记效率;
(4)通透:通透时间过长会增加组织切片在后续洗涤步骤中从载玻片上脱落的风险,过短则可能造成通透处理不充分,影响标记效率,为得到更好的结果,需要优化孵育时间;
(5)标记:标记时间不宜过长;请事先明确TUNEL的分组(阴性、阳性对照,实验组),并严格按照说明书配制反应体系;
(6)终止/洗涤:标记结束后的洗涤,次数可增加到5次;也可在PBS清洗结束后,用含0.1% Triton X-100和5 mg/ml BSA的PBS洗3次,更彻底的将游离未反应标记物清除干净。
Q2:背景比较高( 如未凋亡细胞的强绿色荧光背景),该从哪些方面进行分析?
A2:首先通过结果图片判断到底是真的背景高,还是染上了其他的东西,如果是真的高背景,可以从以下方面进行排查:
- 如果样本是切片,回溯切片制作时有无血液、体液残留;如果是石蜡切片,脱蜡不彻底时石蜡会沾染料造成绿色背景;细胞爬片的本身固定情况,考虑到细胞自身的状态是不是出现破裂;
- 操作过程中应保持湿润状态,不能出现干片的情况,否则会产生高背景;
- 清洗不彻底(部分固定液会带荧光,标记体系没洗干净也会有自发荧光,标记反应完成,载玻片在用PBS洗一遍之后,可再用含0.1% Triton® X-100和5 mg/ml BSA的PBS洗3次,每次5 min);
- 固定试剂或其他成分导致的非特异性染色,建议做阴性对照(不加酶:排除染料的非特异性沾染);
- 曝光强度问题:正确的曝光条件设置是保证阴性对照背景干净,同时阳性对照荧光清晰明亮;
- 自发荧光干扰(容易被误判为全阳,固定步骤没问题的时候建议考虑这个);
- 支原体污染;
- TdT浓度太高,反应时间过长。
Q3:TUNEL检测时组织切片从载玻片上脱落,有哪些原因?
A3:(1)组织切片粘附之前的包被不充分。在展片之前,用3-氨丙基三乙氧基硅烷包被显微镜载玻片比多聚赖氨酸 (poly-L-lysine) 效果更好;
(2)蛋白酶K通透时间过久有造成切片脱落的可能性,建议时间为5 min。
Q4:TUNEL显微镜或流式细胞仪分析只剩下很少的细胞,如何改善?
A4:在操作过程中丢失大量细胞:
- 提高起始的细胞量;
- 在制备贴到显微镜载玻片的细胞悬液时,离心过程中用含1% BSA的PBS洗细胞。
Q5:标记率低的原因有哪些?
A5:(1)通透——通透出问题,需要加大力度通透,检查Triton真假和有效期;
(2)固定步骤——如果以乙醇或甲醇固定的样本则标记效率较低(因为在固定时染色质未能与蛋白质交联,而在操作中丢失),应用溶于1×PBS中的4%多聚甲醛固定或福尔马林或戊二醛固定。过度的固定导致与蛋白过度交联也会导致标记效率低,可以适当缩短固定时间;或用溶于1×PBS的2%多聚甲醛固定;
(3)标记——标记体系配制不对,样本上液体残留太多,标记时间优化;
(4)荧光淬灭——本来染上的较少,切片存放过久;
(5)没有3’-OH存在——部分细胞的凋亡没有3’-OH末端暴露。
Q6:怎样区分非特异性和特异性染色。
A6:同时做阴性/阳性对照。
Q7:结果出现假阳性,如何排查问题?
A7:(1)内源性核酸酶切割——主要是固定没做好,内源性核酸酶残留;
(2)固定液使用不当——酸性固定液会导致非特异性染色;
(3)操作:干片会导致非特异性;
(4)脱蜡和切片制作:蜡、组织中未除净的血液、体液、脂肪等都会沾染料;
(5)切片类型:高速分裂和增殖的细胞(比如说生殖细胞),有时也会出现细胞核中的DNA断裂;
(6)标记体系:TdT酶浓度太高,反应时间过长;
(7)切片保存:光照紫外线导致包埋试剂的聚合(如:甲基丙烯酸会导致样本DNA的断裂);
(8)复染问题:激发光长时间照射PI,PI会发绿光;
Q8:阳性对照做不出来,如何改善?
A8:如果是难操作样本,推荐延长FITC染色时间至2小时,并进行拍摄参数优化。如果排除样本本身的问题,一般阳性做不出来主要有通透,阳性处理和标记孵育等方面出现问题。阳性处理中要注意Buffer用ddH2O稀释,酶要用buffer稀释,酶孵育时间10 min。最好,再注意一下标记液是否配置正确,孵育的时候有没有干片等。
Q9:细胞形态很模糊,荧光很少,背景值很高。
A9:(1) 延长细胞通透时间,操作过程中注意保持湿润,最后观察是加PBS润洗;
(2) 洗片过程中可以加Triton进行洗涤;
(3) 注意PI不要过曝,建议曝光时间1-5 s,稍微调低一点曝光;
(4) 尝试延长37℃孵育时间,剪一小片封口膜把液体盖上,防止干片;
(5) 同时做阴阳性对照排除试剂盒、操作手法和细胞本身的问题。
Q10:如何确定可检测样本范围?
A10:TUNEL检测的是晚期凋亡,所以只要有晚期凋亡,一般都可使用。
Q11: 在整个tunel实验中,是否可以中止实验,过夜处理?
A11: 建议不要中止,如果必须中止,标记结束后,放在4℃冰箱过夜处理。
Q12:细胞固定时将75 %乙醇错加成了100 %,样本是否可以使用?
A12:不能用,高浓度的乙醇会使细胞迅速皱缩,样本会迅速脱水,影响固定的效果。
Q13:组织切片从载玻片上脱落。
A13:组织切片粘附之前的包被不充分。在展片之前,用3-氨丙基三乙氧基硅烷(3-aminopropyl triethoxysilane,TESPA;Sigma Cat.# A3648)包被显微镜载玻片比多聚赖氨酸(poly-L-lysine)效果更好。
Q14:使用Tunel法做石蜡切片和冰冻切片,制作切片的厚度在多少范围,效果比较好?
A14:石蜡切片的厚度是3-5 μm,冰冻切片的厚度是5-10 μm。
其实两种切片的厚度在15 μm以内均可以,但是石蜡切片的厚度若是在10-15 μm范围,可把脱蜡时间延长,直到脱蜡彻底(肉眼可看到)。
相关产品
Annexin V-FITC/PI Apoptosis Detection Kit
A211-01/02





