HiScript III Reverse Transcriptase
杂质耐受度强、更高效的第三代逆转录酶

逆转录;第一链cDNA合成;两步法qRT-PCR检测;cDNA文库构建

· 广泛的模板兼容性:可兼容动物、植物、病毒等多种模板
· 超强的杂质耐受度:对于常见杂质(乙醇、异丙醇、水平衡酚、腐殖酸)均具有超强的耐受度
· 优异的逆转录效率:与市面常见的逆转录酶相比,具有较高的逆转录效率
以1μg HeLa细胞RNA为模板,按照R302说明书推荐体系进行逆转录,以1μl cDNA为模板,用2 × Vazyme Lamp Master Mix (Dye Plus)(Vazyme #P312)进行长片段扩增,将得到的产物进行琼脂糖凝胶电泳,结果如图所示:扩增条带单一且产量高。
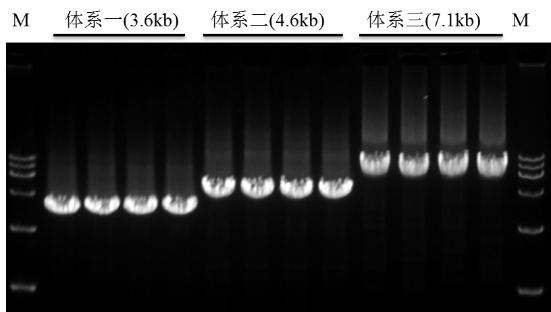
长片段扩增电泳图
注:M:DL15000 Marker(Vazyme #MD103)

本产品为新一代逆转录酶,在37℃条件下即可进行高效率的逆转录反应。本产品依旧保留二代产品的热稳定性,且对于复杂二级结构的RNA,可将逆转录温度提高至50℃-55℃,避免RNA复杂二级结构对cDNA合成的抑制,可有效合成高质量的cDNA。此外,本产品仍具有优异的持续合成能力和强的杂质耐受度。



- 30℃~- 15℃保存。
下一页
Q1:原核生物RNA能用我们的逆转录试剂吗?
A1:可以。原核生物RNA没有polyA尾,所以在逆转录反应体系中需要以Random primer作为逆转录引物。
Q2:延长逆转录时间,是否可以提高逆转录效率?
A2:对于大多数基因,延长逆转录时间对逆转录效率并没有显著提升;对于一些GC含量较高或含高级结构的模板,延长逆转录时间可提升逆转录效率。
Q3:如何评判RNA质量?
A3:RNA质量从两个方面反应:
(1) RNA完整度。通过琼脂糖凝胶电泳验证RNA完整度。以真核生物为例,完整的总RNA有清晰的三条带,分子量从大到小分别为28S、18S、5S,并且28S是18S亮度的两倍;若能看见三条带,但带型模糊或弥散,则说明RNA有部分降解,此时请立即进行逆转录反应,并适量加大模板量;若只能看见分子量很小的一条带或没有条带,则 RNA 已完全降解,需要重新提取。
(2) RNA的纯度。RNA的纯度可以通过OD260/280和OD260/230两个比值是否在1.8-2.1范围内进行判断,蛋白、离子等残留会使比值降低。
Q4:如何选择逆转录的引物?
A4:根据实验的具体情况选择随机引物、Oligo dT或基因特异性引物进行逆转录。
(1) 随机引物:随机结合在RNA的任何区域,适用于rRNA、mRNA、tRNA等所有RNA类型的逆转录反应。
(2) Oligo dT:适用于具有PolyA尾的RNA(原核生物RNA、真核生物的rRNA和tRNA不具有PolyA尾)。 由于Oligo dT结合在PolyA尾上,所以对 RNA 样品的质量要求较高,即使有少量的降解也会使全长cDNA合成量大大减少。
(3) 基因特异性引物:与模板序列互补,适用于序列已知的基因逆转录。
cDNA后续进行PCR扩增长片段,一般用Oligo dT或者基因特异性引物,不建议使用随机引物,因为随机引物是随机结合的,cDNA片段会偏短,可能会对长片段扩增造成稀释,后续扩增不出全长的目的基因;cDNA后续进行qPCR,一般使用Oligo dT和随机引物的混合物,可以避免3’端和5’端的扩增偏好性。
Q5:可以通过测逆转产物cDNA浓度判定逆转效率吗?
A5:不可以,逆转录产物cDNA是混合物,除了cDNA产物以外,还有buffer、逆转录酶、引物,同时还包含未转录的模板RNA,总RNA中的tRNA、rRNA等,都会干扰浓度测定结果,因此不能反应真实的cDNA产量。
下一页
下一页
相关产品
2 × Vazyme LAmp Master Mix (Dye Plus)
P312-02/03
2 × Taq Plus Master Mix Ⅱ(Dye Plus)
P213-01/02/03
ChamQ Universal SYBR qPCR Master Mix
Q711-02/03
R701-01/02





