Mut Express MultiS Fast Mutagenesis Kit V2
一步实现目标质粒不连续多位点(3-5位点)突变

DNA多位点突变

广泛适用:适用于20 kb以内质粒任意位点的扩增
模板使用量低:扩增以指数方式进行,有利于原始甲基化模板的降解
操作简单:扩增产物经DpnI消化后可直接用于重组反应;一步实现目标质粒上3-5个不连续位点(相距超过50 bp)的定点突变
设计简单:提供在线引物设计软件CE Design

使用Mut Express MultiS 进行不连续三点突变实验流程:
以待突变位点A、B、C 为界,将质粒分为AB、BC 和CA 三段。在每个待突变位点处设计部分反向互补的引物。以原始质粒为模板,分别扩增AB 段(A Forward Primer 和B Reverse Primer)、BC 段(B Forward Primer 和C Reverse Primer) 和CA 段(C Forward Primer和A Reverse Primer) (I)。扩增产物经DpnI消化(I) 后,进行重组环化(II)。重组产物直接进行转化即可完成定点突变(III)。
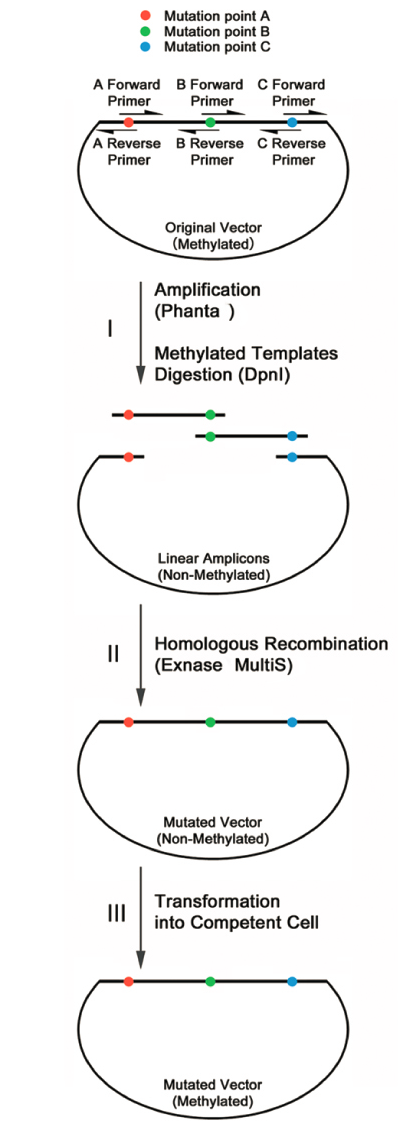
本试剂盒是基于ClonExpress快速克隆技术的多位点定点突变系统,专门针对多位点定点突变而优化的重组酶和反应缓冲液,可一次性向目标质粒上三至五个不连续位点同时引入定点突变,操作简便,成功率高。该试剂盒由Phanta Max Super-Fidelity DNA Polymerase扩增模块和ClonExpress快速克隆模块组成,扩增模块较高的保真度降低了扩增过程中引入新突变的可能性,高效同源重组技术提高了环化效率。使用本试剂盒进行DNA定点突变时,引物设计灵活、模板需求量低,且如扩增产物特异,DpnI消化后可不进行DNA纯化而直接用于重组反应。



- 20℃储存
Q1: 点突变引物设计
- 引物由两部分组成:反向互补序列(15-20 bp,GC含量40%-60%)+非互补序列(至少15bp),待突变位点至引物3'端Tm值>60℃为佳,待突变位点至引物5'端区域内碱基不应参与Tm值计算。
- 引物设计:官网引物设计软件CE Design,选择相应模块进行设计。
Q2:质粒模板无法正常扩增
- 引物设计有误:核对引物设计方案,建议用官网引物设计软件CE Design进行设计。
- 模板质粒:质粒质量偏差会影响扩增效率,长期放置、反复冻融会导致模板质粒断裂、开环或降解,应使用新鲜制备的质粒作为模板(建议质粒模板测序验证序列无问题);质粒如果太大(>9kb),扩增有一定的难度。
- 扩增体系:质粒模板投入量过多,模板投入量过多会抑制PCR反应,导致PCR产物很少,建议50μl体系投入1ng质粒模板;检查体系配制是否错误。
- 扩增反应条件需优化:调整Mg2+浓度、酶量、摸索退火温度等。
- 若质粒过长不容易扩增或扩增效率极低,可以将单碱基突变方案改为双碱基突变:其中一个位点不进行碱基修改即可。
Q3:平板上长不出克隆或者克隆数很少。
- 感受态效率低:使用新制备或妥善冻存的感受态细胞,确保转化效率需>107 cfu/μg。每次可设置一组转化质粒的对照试验,以检测感受态细胞的转化效率;
- 重组反应体系中DNA量不足或比例不佳(双碱基突变):尽量按照说明书推荐的量配置重组体系。请务必预先检测DpnI消化产物的浓度。常用的吸光度测量法极易受DNA纯度、DNA稀释液pH等因素影响,测定值和DNA实际浓度往往偏差非常大;
- 重组环化反应体系中DNA不纯,抑制反应:未纯化DpnI消化产物加入重组体系内的总体积不应超过4ul(反应体系体积1/5)。尝试对DpnI消化产物进行胶回收纯化。重组反应体系中应尽量避免金属络合剂(如EDTA)的带入。因此,我们推荐您将DNA纯化产物溶解在pH8.0的ddH2O中保存(常规胶回收试剂盒中的洗脱液可用pH8.0的ddH2O替代),请勿使用TE进行DNA保存;
- 感受态细胞中加入了过多的反应产物:反应产物的转化体积不应超过感受态细胞体积的1/10,否则会降低转化效率;
- 出现转化抑制效应:当转化的DNA浓度太高时,会抑制转化反应,将重组反应产物稀释5倍后取1/5进行转化。
Q4: 非目标位点突变
- 测序:如果只测了一个样本,不一定可信,需要多测几个样本;检查突变处的测序信号是否有问题,若为双峰或者杂峰则不一定可信。
- 若突变位点一致,可能是模板质粒携带位置为点突变,测序确认模板质粒序列正确性。
- 扩增循环数过多:为了防止扩增过程中引入非目标突变,扩增循环数不宜超过35。如果扩增效率良好的话,推荐扩增循环数不应超过30。
相关产品
GR501-01/02
MD101-01/02
MD102-01/02
MD103-01/02
MD104-01/02





