HiScript III RT SuperMix for qPCR (+gDNA wiper)
杂质耐受度强、更高效的第三代qPCR专用逆转录预混液(去基因组)

第一链cDNA合成;逆转录;基因表达分析;两步法qRT-PCR检测

· 简便快捷的操作:5 × HiScript III qRT SuperMix包含逆转录反应所需的所有组分,只需加入模板 RNA,18 min内即可完成逆转录反应
· 广泛的模板兼容性:可兼容不同物种,完整度较差的 RNA 模板
· 较强的杂质耐受度:对于逆转录常见杂质如乙醇、异丙醇、水平衡酚、异硫氰酸胍、腐殖酸等,具有较强的耐受度
· 优异的逆转录效率:与常见逆转录产品相比,HiScript III RT SuperMix for qPCR (+gDNA wiper) 逆转得到的cDNA定量CT值小,具有优异的逆转录效率
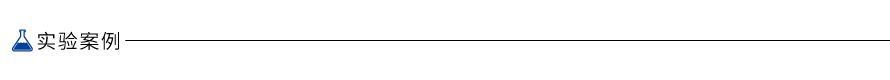
1.简便快捷的操作
HiScript III RT SuperMix for qPCR (+gDNA wiper)(Vazyme #R323)包含基因组清除模块,可彻底去除 RNA 模板中残留的基因组 DNA;同时Vazyme #R323 包含逆转录反应所需的所有组分,只需加入模板 RNA,18 min 内即可完成逆转录反应,操作简便快捷。
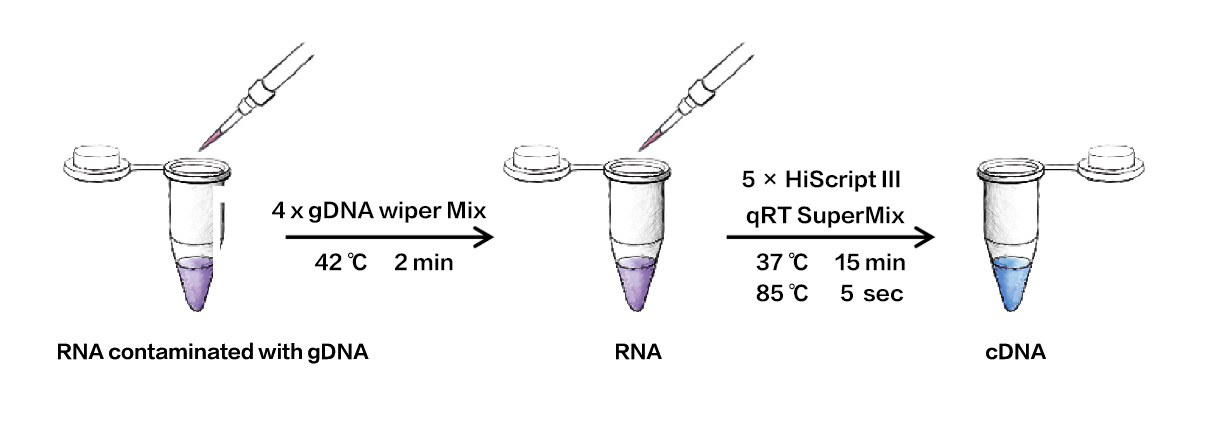
2.广泛的模板兼容性
分别以 HeLa 细胞、小鼠肝脏、拟南芥叶片的完整 RNA 与降解 RNA 为模板,使用 HiScript III RT SuperMix for qPCR (+gDNA wiper) (Vazyme #R323)以及常见逆转录试剂 (Supplier T) 进行逆转录。将得到的 cDNA 进行多个基因的 qPCR 定量分析,以不同基因为横坐标,扩增 CT 值为纵坐标绘图,比较不同产品的逆转录效率。从图中可以看出,以 HeLa 细胞、小鼠肝脏、拟南芥叶片完整 RNA 以及降解 RNA 为模板进行逆转录定量,Vazyme #R323的扩增CT 值小于或等于T公司相关产品,说明Vazyme #R323逆转不同物种RNA、完整度较差的RNA模板皆具有优异的逆转录效率。
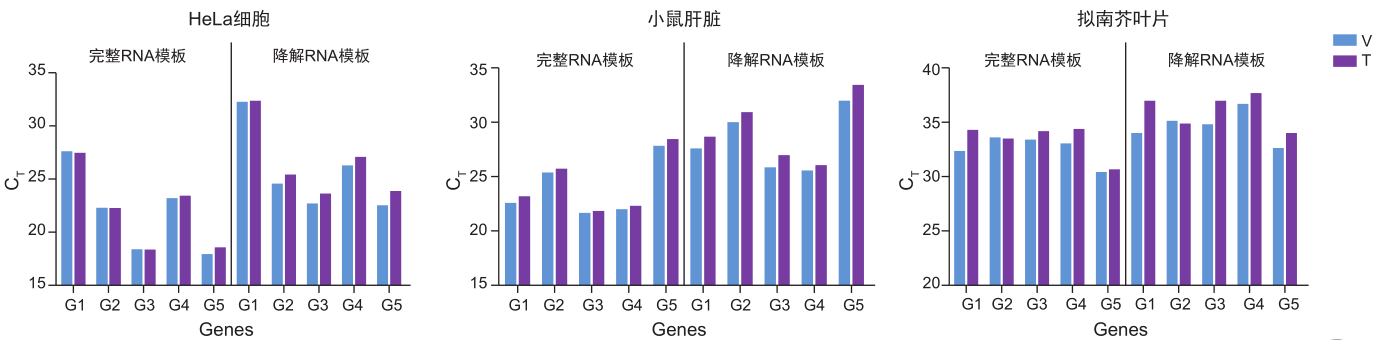
3. 较强的杂质耐受度
在RNA的提取过程中常常因操作或样本的特殊性导致RNA中混有有机试剂或杂质,这些物质的残留会严重影响逆转录效率。乙醇、异丙醇、水平衡酚、异硫氰酸胍、腐殖酸是 RNA 提取过程中较为常见的杂质,测试其对逆转录效率的影响。
分别对上述 5 种杂质设置 3 个不同浓度梯度,添加至 HiScript III RT SuperMix for qPCR (+gDNA wiper) (Vazyme #R323) 逆转录体系中,将得到的 cDNA 进行 qPCR 检测。以不同浓度杂质为横坐标,△CT (△CT = 含杂质逆转录 cDNA 扩增 CT 值 – 未含杂质逆转录 cDNA 扩增 CT 值 ) 为纵坐标绘图。从图中可以看出,△CT 均小于 0.15,说明 Vazyme #R323 对上述 5 种常见杂质具有较强的耐受度。
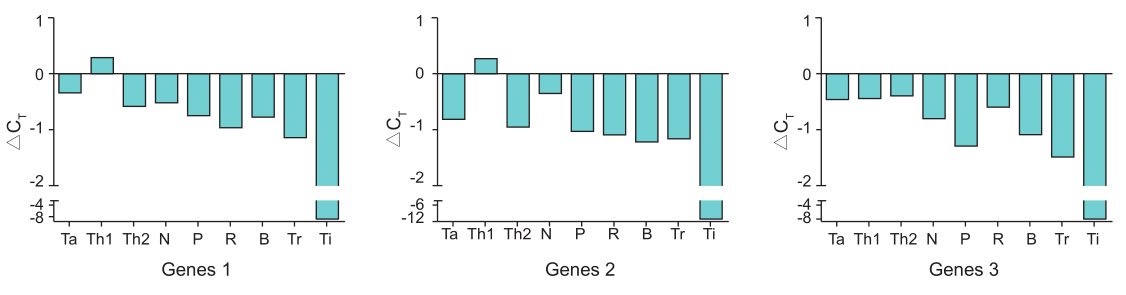
4. 优异的逆转录效率
以 100 ng HeLa RNA 为模板,使用 HiScript III RT SuperMix for qPCR (+gDNA wiper) (Vazyme #R323) 以及其他逆转录产品,按照各自说明书推荐程序进行逆转录反应。将得到的 cDNA 进行多个基因的 qPCR 定量分析。以不同公司产品为横坐标,△CT (△CT = Vazyme #R323 cDNA 扩增 CT 值 – 各公司逆转录产品 cDNA 扩增 CT 值 ) 为纵坐标绘图。从图中可以看出,除一些体系Th1 △CT >0 外,其余公司逆转录产品均△CT <0,说明 Vazyme #R323 逆转录效率优于 Ta、Th2、N、P、R、B、Tr、Ti 相关逆转录产品。

本产品包含了全新升级三代逆转录酶和专门针对逆转录特殊优化的 Buffer,可有效提高cDNA合成效率。产品所包含的基因组清除模块可去除RNA模板中残留的基因组DNA,确保后续结果更加可靠。与此同时,本产品将所有逆转录反应所需组分融于一管,只需加入模板 RNA,20min内即可完成逆转录反应,同时终止gDNA wiper作用,保证cDNA的完整性,减少了操作步骤,并有效防止了在操作过程中带来的污染。



- 30℃~- 15℃保存。
Q1:如何评判RNA质量
A1:RNA质量从两个方面进行检测:
⑴ RNA完整度。通过琼脂糖凝胶电泳验证RNA完整度。以真核生物为例,完整的总RNA有清晰的三条带,分子量从大到小分别为28S、18S、5S,并且28S是18S亮度的两倍;若能看见三条带,但带型模糊或弥散,则说明RNA有部分降解,此时请立即进行逆转录反应,并适量加大模板量;若只能看见分子量很小的一条带或没有条带,则RNA 已完全降解,需要重新提取
⑵ RNA的纯度。RNA的纯度可以通过测定OD260/280和OD260/230两个比值,在1.8-2.1范围内表示纯度较高。
注:建议使用1%的琼脂糖凝胶,210V电泳10-12min;加好loading后的RNA可以放置在PCR仪上70℃,2min,使RNA变性后再进行电泳,这样跑出来的RNA条带更好看,也更能反应RNA的完整性;
Q2:如何选择逆转录的引物
A2:逆转录三种引物:
⑴ 随机引物:随机结合在RNA的任何区域,适用于rRNA、mRNA、tRNA等所有RNA类型的逆转录反应。
⑵ Oligo dT:适用于具有PolyA尾的RNA(原核生物RNA、真核生物的rRNA和tRNA不具有PolyA尾)。 由于Oligo dT结合在PolyA尾上,所以对 RNA 样品的质量要求较高,即使有少量的降解也会使全长cDNA合成量大大减少。
⑶ 基因特异性引物:与模板序列互补,适用于序列已知的基因逆转录。
引物选择依据: cDNA后续进行PCR扩增长片段,一般用Oligo dT或者基因特异性引物,不建议使用随机引物,因为随机引物是随机结合的,cDNA片段会偏短;cDNA后续进行qPCR,一般使用Oligo dT和随机引物的混合物,可以避免3’端的扩增偏好性。
Q3:对于逆转录加样的操作注意事项
A3:⑴ 4 × gDNA wiper Mix、5 × HiScript III qRT SμperMix及5 × No RT Control Mix含有高浓度的甘油,在使用前请短暂离心收集到反应管底部,并用移液枪轻轻吸打充分混匀后准确吸取。
⑵ 20 µl逆转录反应体系建议加入不超过1 µg的Total RNA。如果目的基因表达量非常低,最多加入5 µg total RNA,否则加入RNA量过高, 可能会超出后续定量PCR的线性范围。
⑶ 可以不进行基因组去除步骤,直接用逆转录试剂进行逆转录,但是请勿将4 × gDNA wiper Mix与不含基因组去除模块的试剂配套使用(如与R222配套使用),因为不含基因组去除模块的试剂盒中的Mix不含终止gDNA wiper反应的成分,有可能会影响cDNA稳定性。
Q4:可以通过检测逆转产物cDNA浓度判定逆转效率吗?
A4:不可以,逆转录产物cDNA是混合物,除了cDNA产物以外,还有bμffer、逆转录酶、引物,同时还包含未转录的模板RNA,总RNA中的tRNA、rRNA等,都会干扰浓度测定结果,因此不能反应真实的cDNA产量;cDNA同样不可以纯化,因为逆转得到的cDNA长短不一,纯化会损失短的cDNA。
Q5:cDNA模板需要稀释吗?应该稀释多少倍进行定量?
A5:没有具体的稀释参考倍数,一般cDNA每稀释10倍CT值变大3.3,可以根据这个规律进行合适的稀释。可以使用cDNA原液、10倍稀释液、100倍稀释液作为模板进行定量实验,根据规律选择CT值落在18-28范围内的稀释倍数。也可以参考换试剂之前的稀释倍数。
注:当使用 cDNA 原液进行检测的时候,使用量不能超过qPCR 反应体系的 1/10,因为 cDNA 中包含很多抑制 qPCR 的组分,cDNA 体积大时风险很高。
Q6:逆转录试剂盒可以用于lncRNA和cirRNA吗?
A6:可以,和普通的RNA逆转类似。不过lncRNA比较长,建议在去除基因组步骤前先进性65℃ 5min预变性,打开二级结构再进行逆转录。并不是所有的LncRNA都包含PolyA 尾,所以如果使用逆转录试剂盒,可以同时添加随机引物与OligodT两种引物,或者只添加随机引物一种引物,但不能只添加Oligo dT一种引物。
cirRNA为环状闭合结构,没有poly A尾,逆转录时只加随机引物。cirRNA长度跨度较大,比较长的话建议跟lncRNA一样先预变形,正常的话就按照正常程序就行了。
关于引物的选择,总的来讲:
mRNA可以选用随机引物+OligodT;随机引物;OligodT;GSP(基因特异性引物);
cirRNA可以选用随机引物;GSP(基因特异性引物);
LncRNA可以选用随机引物+OligodT;随机引物;GSP(基因特异性引物);LncRNA在进行逆转录之前需要进行RNA预变性。
Q7:与二代逆转录产品相比,三代逆转录产品的优势是什么?
A7:(1)与二代产品相比,三代酶CT值偏小1-2 Cycles;
(2)三代产品对于降解的RNA逆转录效率高,可逆转Rin=2.5的RNA;
(3)在高RNA模板(1-5 μg)投入的情况下,依然具有很高的逆转录效率;
(4)对乙醇、异丙醇、酚、异硫氰酸胍(RNA提取中引入的杂质)等常见杂质耐受度极高。
相关产品





