AceQ Universal U+ Probe Master Mix V2
基于 Heat-labile UDG 防污染的通用型探针法定量 PCR 检测试剂盒

基因表达分析

· 优异的扩增灵敏度:严谨的化学法热启动酶 Acetaq DNA Polymerase,配合精心优化的缓冲体系,可以检测出低至单拷贝模板
· 优异的线性关系:在宽广的模板区间内具有良好的线性关系,扩增效率高达 99%
· dUTP/UDG 防污染系统:引入 Heat-Labile UDG 防污染体系, Heat-labile UDG 在室温下即可将含 U 的污染物迅速降解,消除了扩增产物污染对qPCR反应的影响
· 广泛的平台适用性:特殊的 ROX 参比染料,适用于所有 qPCR 仪,无需在不同的 QPCR 仪器上调整 ROX 浓度
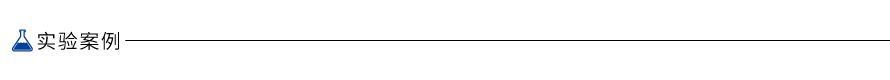
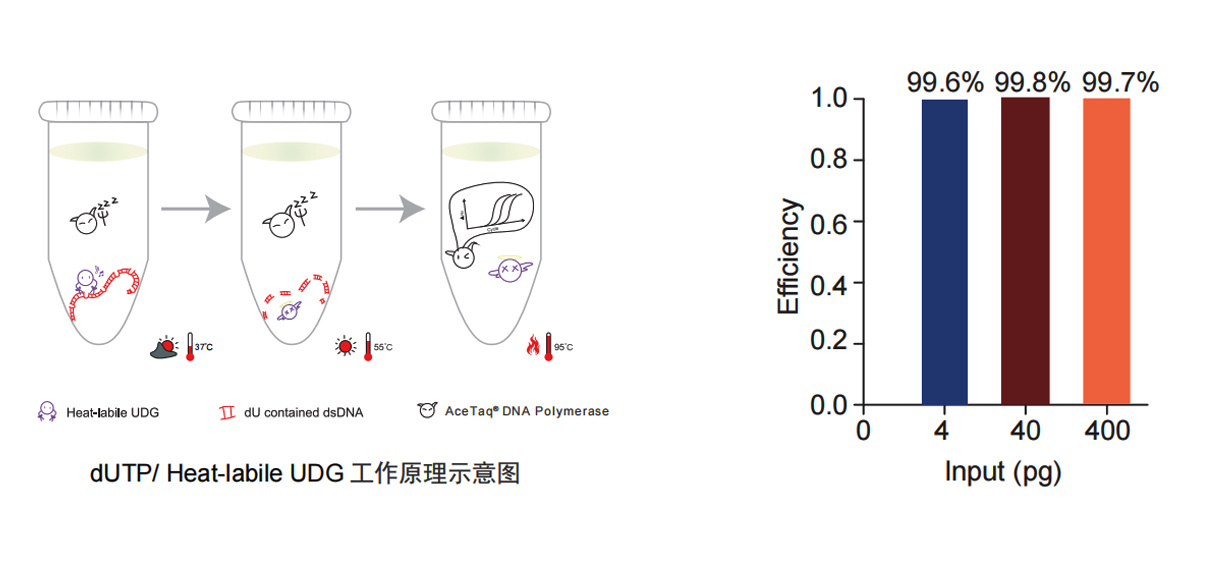
图1.优异的线性关系
以质粒 Puc57-Kan 为模板,进行 7 个 10 倍梯度稀释,第 7 个稀释梯度中质粒拷贝数浓度约为 8 copies/4 μl。使用 AceQ Universal U+ Probe Master Mix V2(Vazyme #Q513)对各稀释梯度中的 Puc57-Kan 进行检测,每孔模板使用量为 4 μl。可以看到,Vazyme #Q513 预混液在宽广的模板量区间内具有优异的线性关系,可以轻松检测出个位数拷贝的待测模板。
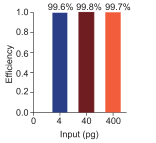
图2.dUTP/Heat-labile UDG 防污染系统
AceQ Universal U+ Probe Master Mix V2 (Vazyme #Q513)引入 dUTP/ Heat-labile UDG 防污染系统,室温条件下即可有效清除体系中存在的污染物,同时当反应体系升温至 50℃-55℃时,Heat-labile UDG 迅速彻底失活,可维持 cDNA 的完整性,确保检测灵敏度不受影响。在反应体系内分别添加 4 /40 /400 pg 的含 U 模板,测试 Vazyme #Q513 预混液对污染模板的清除效率。结果可见,Vazyme #Q513 预混液对污染模板的清除效率高达 99.6% 以上,可有效保证实验结果的准确度。
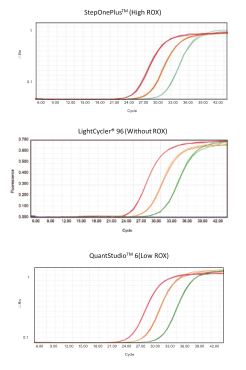
图3.广泛的平台适用性
以 HeLa 细胞 cDNA 为模板,进行 3个10 倍梯度稀释,使用AceQ Universal U+ Probe Master Mix V2 (Vazyme #Q513)在不同类型qPCR仪 ( 机 型:StepOnePlus 、LightCycler 96、QuantStudio 6) 上扩增不同稀释梯度cDNA的GAPDH基因,定量结果优异。说明 Vazyme #Q513 预混液仪器适用性广,无需针对不同仪器调整 ROX 浓度。

AceQ Universal U+ Probe Master Mix V2 采用严谨的化学修饰 Acetaq, 配合精心优化的缓冲体系,能够较大程度提高探针法定量的灵敏度。 AceQ Universal U+ Probe Master Mix V2 添加了dUTP/UDG 防污染系统,降低因探针法的高灵敏度造成的假阳性, 较大限度保证了结果的真实性。同时, AceQ Universal U+ Probe Master Mix V2 还采用了特殊的 ROX Passive Reference Dye,适用于所有的 qPCR 仪,无需调整ROX 浓度,使用方便。



-20℃避光储存。
4℃存放3周;可冻融30次;
配制好的混合体系(引物、模板、试剂)可于4℃存放6h。
Q1:QPCR 设计引物应该注意什么?
A1:(1)扩增产物推荐长度 80-200bp,越短扩增效率越高,为了和引物二聚体做明显区分,长度要大于80bp,太长会导致扩增效率下降;
(2)3’端尽量避免高GC或高AT含量区域;
(3)最后一个碱基最好为G或者C,避免使用T;
(4)正反向引物的Tm值最好相差不要超过1℃;
(5)GC含量最好在40-60%;
(6)如果后续用探针法,注意探针Tm值高于引物Tm值8-10℃。
Q2:cDNA模板需要稀释吗?应该稀释多少倍进行定量?
A2:没有具体的稀释参考倍数,一般cDNA每稀释10倍CT值变大3.3,可以根据这个规律进行合适的稀释。可以使用cDNA原液、10倍稀释液、100倍稀释液作为模板进行定量实验,根据规律选择CT值落在18-28,或者15-33范围内的稀释倍数。也可以参考换试剂之前的稀释倍数。
注:当使用 cDNA 原液进行检测的时候,使用量不能超过qPCR 反应体系的 1/10,因为 cDNA 中包含很多抑制 qPCR 的组分,cDNA 体积大时风险很高。
Q3:扩增曲线形状异常
A3:(1) 扩增曲线不光滑:信号太弱,经系统矫正后产生。建议提高模板浓度重复实验。
(2) 扩增曲线断裂或下滑:一般由于模板浓度较高,基线的终点值大于CT值。建议减小基线终点(CT值-4),重新分析数据。
(3) 个别扩增曲线突然骤降:反应管内留有气泡,由于温度升高后气泡破裂,使仪器检测到的荧光值突然降低所致。建议反应前要仔细检查反应管内是否有气泡残留。
(4) 扩增曲线呈锯齿状且不连续:ROX添加不当。需校正参比染料。
Q4:标准曲线扩增小于90%或者大于120%,线性关系不佳
A4:(1)加样误差。加大模板稀释倍数,提高加样体积,使用不同稀释梯度的浓度更准确;
(2)标准品降解,重新制备标准品,重复实验;
(3)模板浓度过高,存在抑制反应,增加模板稀释倍数;
(4)引物扩增特异性不好,重新设计引物重复实验。
Q5:反应结束无扩增曲线出现
A5:⑴ 反应循环数不够:一般设置循环数为40,但需要注意的是过多的循环会增加过多的背景信号,降低数据可信度。
⑵ 确认程序中是否设置了信号采集步骤:两步法扩增程序一般将信号采集设置在退火延伸阶段;三步法扩增程序应当将信号采集设置在72℃ 延伸阶段。
⑶ 引物不合适:重新设计引物;确认引物是否降解:长时间未用的引物应先通过PAGE电泳检测完整性,以排除其降解的可能。
⑷ 模板浓度太低:减少稀释度重复实验,一般未知浓度的样品先从最高浓度做起。
⑸ 模板降解:重新制备模板,重复实验。
Q6:CT值的有效性判断
A6: (1) 融解曲线单峰(染料法)
(2) 扩增曲线指数扩增区域,复孔间CT值STD<0.2
(3) 阈值设置合理
(4) NTC确认无气溶胶污染或可以忽略
(5) NRT确认无基因组残留污染或可以忽略
(6) 扩增效率符合近似计算标准,标准曲线相关系数R2大于0.98,扩增效率e介于95-105%或者90-120%之间。
Q7:CT值出现太晚。
A7:(1) 扩增效率极低。优化反应条件,尝试三步法扩增程序,或者重新设计合成引物。
(2) 模板浓度太低。减少稀释度重复实验,一般未知浓度的样品先从最高浓度做起。
(3) 模板降解。重新制备模板,重复实验。
(4) PCR产物太长。推荐PCR产物长度为80 bp-150 bp。
(5) 体系中存在PCR抑制剂。一般为模板带入,加大模板稀释倍数或者重新制备模板重复实验。
Q8:NTC(阴性对照)出现CT值,目的基因的CT值还能使用吗?
A8:NTC出现扩增一般会有两种情况:
⑴ NTC与目的基因融解曲线峰形不重叠。一般NTC的Tm值较目的基因Tm值小。这种情况下,NTC的CT值是由引物二聚体造成的,并不影响目的基因CT值的采集。
⑵ NTC与目的基因融解曲线峰形重叠。NTC的Tm值等于目的基因的Tm值。
这种情况下,说明体系已被气溶胶污染了。体系被污染,目的基因的CT值还能正常使用吗?
需要计算目的基因的CT值与NTC 的CT值的差值(△CT)差值来判定。若△CT≥5/3,说明气溶胶带来的污染对体系影响非常小,可以忽略不计。若△CT<5/3,说明污染比较严重,目的基因的CT值是不能使用的。
Q9:NRT出现明显扩增
A9:NRT出现明显扩增说明有基因组污染可通过实验组和NRT的CT之差异来判断实验数据是否可用。当实验组CT值和NRT CT值差值大于5,说明邮gDNA但值得误差小于5%,则可以忽略;若实验组CT值和NRT CT值差值大于3或者几乎一致,则实验组扩增产物的模板很大部分来源于gDNA,这样的实验组就失去定量意义,建议使用去基因组的RNA提取试剂盒进行RNA提取,或者反转录时加入去基因组步骤。
Q11:定量仪器报错出现BadRox?
A11:遇到BadRox 的问题,可能出现的原因有:
⑴ 仪器问题:仪器需要校准,ABI 仪器需要每年校准一次,长时间不校准,会出现荧光信号采集异常;仪器老化,同样需要请仪器工程师进行校准或更换零部件。
⑵ 客户体系过低,如10μl 扩增体系,因添加体系较低而导致ROX总浓度偏低,易出现BadRox现象。
⑶ 试剂本身添加的ROX浓度较低,低于仪器检测的阈值
Q12:实验重复性差
A12:(1)加样体积失准,使用准确度较好的移液枪,扩大反应体系,将模板做高倍稀释,以大体积加入反应体系中;
(2)定量PCR仪不同位置温度控制不一致。定期校准仪器。
(3)模板浓度太低。模板浓度越稀,重复性越差,减少模板稀释度或提高加样体积。
(4)做4-6个复孔,删除其中重复性不好的孔,将剩余的进行后续计算。
Q13:高GC含量的模板,建议用什么产品进行定量?
A13:建议用Q111进行定量
Q14:如果内参CT值很低,目的基因CT值很高,该如何稀释样品?
A:14:可以在定量内参的时候将模板稀释,而定量目的基因时模板不稀释,结果仍旧采用 2-ΔΔCT进行计算,CT值减两次,稀释倍数会被相应减掉,但要保证不同样品在检测同一基因时稀释倍数要一致。
Q15:模板的稀释液选择。
A15:稀释模板可以使用购买的Nuclease-free water、DEPC水或者实验室自备的ddH2O等。TE里有EDTA会抑制酶的活性,不可作为稀释液。
Q16:如何消除体系中的气溶胶污染?
A16:⑴ 更换新的Mix、引物、模板。
⑵ 反应体系尽可能在超净台内操作,减少气溶胶污染。超净台内台面需要定期使用稀释后的84消毒液进行擦拭,使用酒精棉球擦拭移液器,并使用紫外灯照射,以消除长期加样造成的核酸污染。
⑶ 严禁在加样房间打开qPCR产物的管盖。
⑷ 使用Vazyme #R504 RNA酶和核酸清除剂。
Q17:如何确定基因表达量高低。
A17:如果基因扩增CT值超过30,使用PCR产物通过梯度稀释创建标准曲线,判断该引物扩增效率,若扩增效率满足90-120%,则可以判断该基因扩增CT值偏大是由于基因表达量低所致。
Q18:复孔间重复性差?
A18:复孔间重复性差一般会有两种情况:
情况1:CT值很大,如CT≥30,重复性差属于正常现象。该现象符合泊松分布,即在有效模板量很少的情况下,模板与引物的碰撞存在随机性,直接导致复孔间的CT值差异较大。
解决方法:如果融解曲线没有杂峰,无模板阴性对照同目的基因的△CT值为5以上,那CT值为准确的,可多设置几个复孔,选择重复性好的CT值参与计算。
情况2:CT值正常,如CT<30,重复性较差。一般同操作有关。
解决办法:从以下几个方面进行问题的排查:
①加样准确度;②移液器吸取液体的准确度;③定期校准qPCR仪。
- 加样准确度
⑴避免小体积加样,减少加样误差。可以将引物、SYBR Green Mix、ddH2O配置成混合体系,并且增加模板的稀释梯度,大体积加样。如:原液cDNA添加1μl,可以更改为原液cDNA稀释5倍,添加5μl,使用ddH2O补齐体系至20μl即可。
⑵SYBR Green Mix、配置的混合体系需要混合均匀。从-20℃冰箱拿出的试剂需要完全融化并上下颠倒彻底混匀;配置体系时,将混在一起的Mix用移液器吹打混匀。
- 移液器吸取液体的准确度
⑴移液器量程定期校准,校准周期为1年。
⑵购买与移液器配套的枪头,若枪头与移液器不匹配,在吸取液体时易出现漏气的现象,导致吸取量程不准确。在吸取相同量程的液体体积时,注意观察每次吸取液体在枪头内的液面高度是否一致。
- 定期校准qPCR仪:一般qPCR仪校准周期为一年。
Q19:相对定量为什么要做标准曲线?
A19:相对定量分析中采用2-ΔΔCT公式进行计算比较不同样品中基因的表达量时,前提是该体系的扩增效率e是尽可能接100%的。相对定量中做标准曲线的目的就是为了判断该扩增体系中的扩增效率e是否是接近100%,能否用2-ΔΔCT公式进行计算;如果扩增效率e与100%相差很大,在比较基因表达差异时是需要带入实际的扩增效率进行计算的。
Q20:怎么做绝对定量?
A20:首先需要有一个已知拷贝数浓度的样品作为标准品,将其稀释至少5个梯度后和待测样品同时上机进行定量检测,以标准品拷贝数的Log值为横坐标,以标准品的CT值为纵坐标绘制标准曲线方程,将检测获得的待测样品的CT值带入标准曲线方程中就能求得待测样品的拷贝数浓度。
相关产品
R701-01/02





