Lipomaster 2000 Transfection Reagent
转染效率高,细胞毒性小的脂质体转染试剂

适用于多种贴壁/悬浮细胞的质粒DNA、RNA转染

- 细胞兼容广,可用于多种贴壁/悬浮细胞的转染
- 转染效率高,对于质粒DNA、RNA均能实现高效转染
- 细胞毒性低,转染后无需更换培养基

Lipomaster 2000 Transfection Reagent是一种由脂质体介导的转染试剂,适用于多种贴壁或悬浮细胞的质粒DNA、RNA转染。本产品经过精心设计,使其兼具优异的脂质体/核酸复合物形成能力和转染到细胞内核酸的快速释放能力,保证了优异的转染性能和较低的细胞毒性。形成的脂质体/核酸复合物可以直接加入完全培养基中,血清和抗生素的存在不影响其转染效果,转染前后不需要更换培养基,操作十分简便。
 1. 细胞兼容性
1. 细胞兼容性
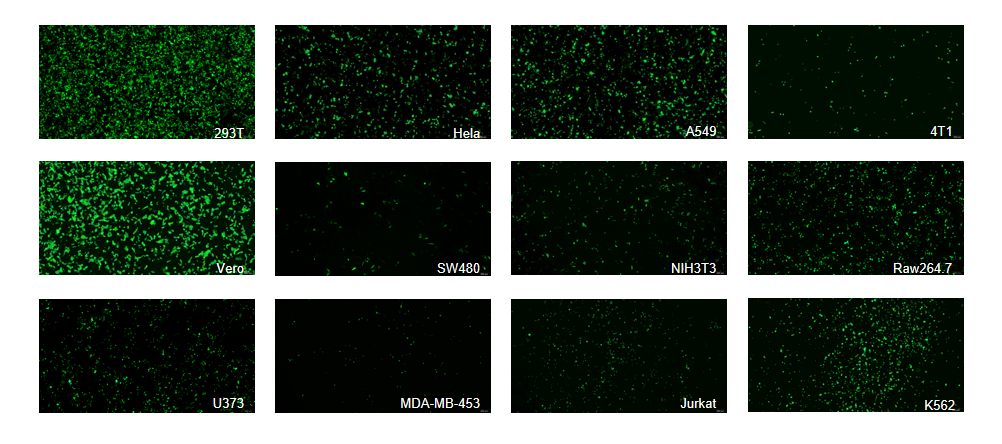
使用Vazyme #TL201转染单质粒至多种贴壁/悬浮细胞,均可以实现有效转染。
2.转染效率
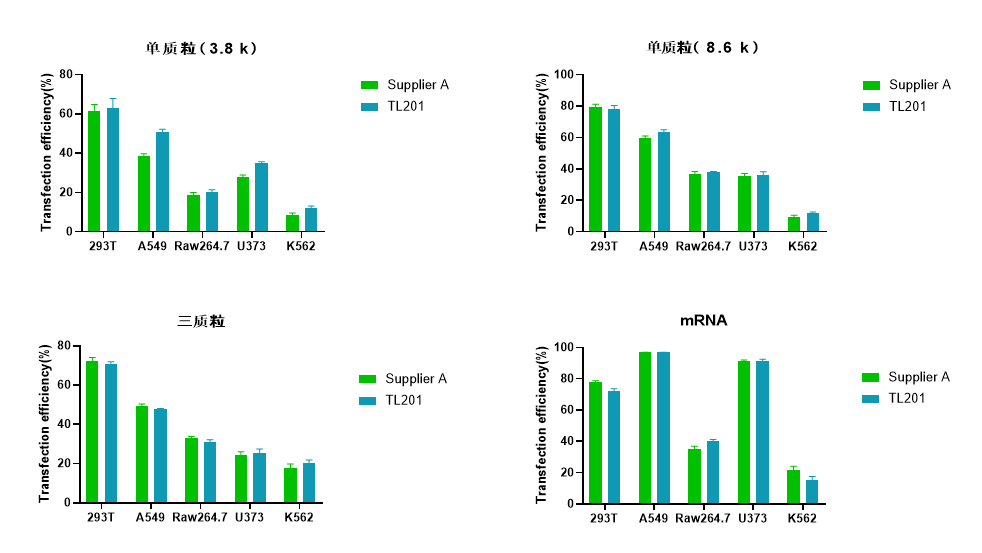
使用Vazyme #TL201及Supplier A转染试剂分别转染单质粒(3.8 k和8.6 k)、三质粒和mRNA至多种贴壁/悬浮细胞中,结果表明,Vazyme #TL201在多种细胞中的转染效率与Supplier A一致。
3.细胞毒性
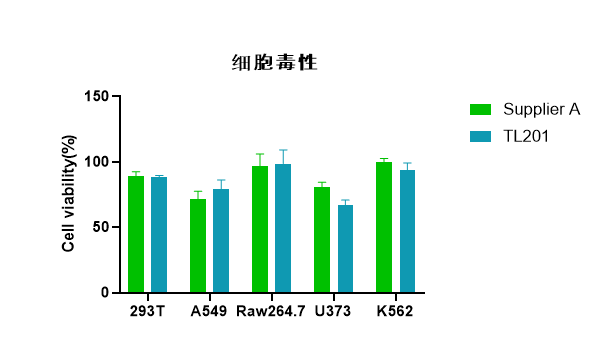
在贴壁/悬浮细胞中,测定Vazyme #TL201及Supplier A转染试剂的细胞毒性,结果表明,Vazyme #TL201在多种细胞中的细胞毒性与Supplier A一致。



2 ~ 8℃保存
Q1:转染效率偏低
A1:①Lipomaster 2000 与DNA的比例不合适
通过预实验优化Lipomaster 2000与DNA的比例:在Lipomaster 2000 1-5 μl/μg DNA范围内尝试,优化DNA的使用量:以24孔板为例,在0.5-2 μg/孔范围内优化。在后续的实验中选择转染效率高、细胞毒性低的比例进行转染。
②Lipomaster 2000原液或/和DNA原液未经无血清培养基稀释直接混合,Lipomaster 2000和DNA需分别在无血清培养基条件下按一定比例稀释后再进行混合孵育。
③转染时细胞密度不合适
多数情况下,当细胞汇合度达到60%-80%时,转染可以取得较高的转染效率。然而细胞类型不同,合适的转染密度也不尽相同,可以通过预实验优化细胞转染密度。
④DNA质量偏低(降解或内毒素)
为实现高效率、低毒性的转染,应使用高纯度、无菌、无内毒素的质粒DNA。
⑤细胞状态偏差
传代次数太少或者太多都将导致细胞转染效率的改变。因此,为了提高转染效率以及转染稳定性,应尽量使用适度传代的细胞系,并尽量在平行实验时保持细胞传代次数的一致性。另外,支原体的感染或爆发会影响细胞的转染效率,建议使用支原体检测和/或清除试剂盒处理。
Q2:转染后细胞状态差
A2:①转染后细胞培养时间过长
多数情况下,在完全培养基中进行转染,24 h内无需换液处理,但是培养时间过长可能会导致细胞状态较差,建议根据实验需要合理安排后续实验时间。
②转染时细胞密度不合适
多数情况下,当细胞汇合度达到60%-80%时转染可以取得较高的转染效率。细胞密度过低导致细胞生长缓慢,对外来刺激变得较为敏感,使得转染毒性增高。细胞密度过高,会导致细胞发生接触抑制,加快细胞凋亡。
③Lipomaster 2000/DNA过量
转染试剂过量会导致较高的细胞毒性。尝试降低转染试剂的使用比例或者减少DNA用量。
④Lipomaster 2000/DNA复合物加入培养基时分布不均匀
局部Lipomaster 2000/DNA复合物浓度过高是导致细胞毒性偏高的常见原因之一。当Lipomaster 2000/DNA添加到细胞培养孔/皿之后,应即刻轻轻摇动培养板/皿,使之完全混匀。
⑤细胞状态偏差
传代次数太少细胞状态未恢复,或者传代次数太多细胞老化,都将由细胞生长状态不适而导致转染试剂毒性增加。因此应尽量使用适度传代的细胞,降低细胞代次差异对实验结果造成的影响。
相关产品
T101-01/02





