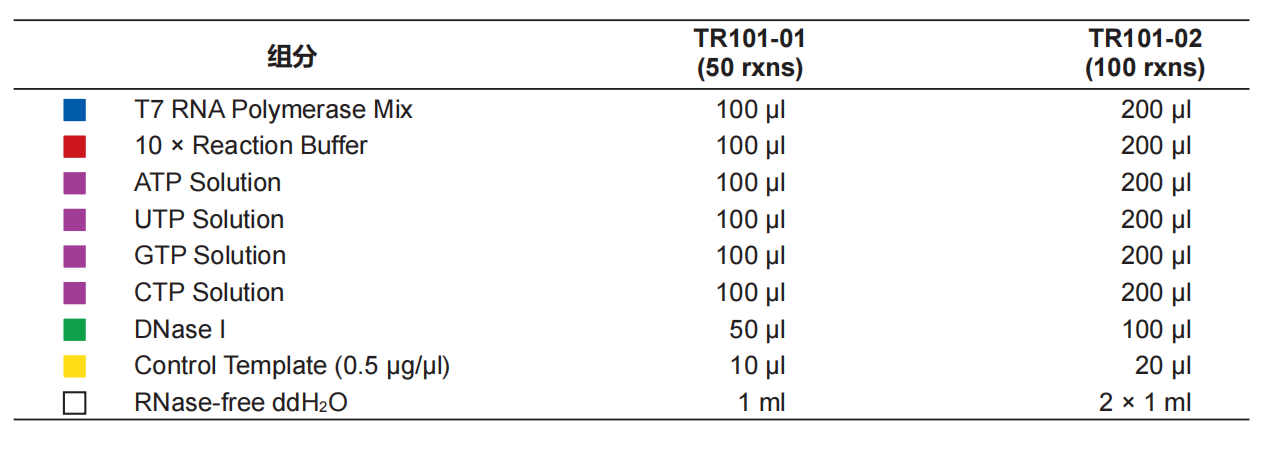
T7 High Yield RNA Transcription Kit
用于体外RNA 合成

体外 RNA 的合成;产物可用于RNA结构与功能研究、RNA酶保护、探针杂交等

· 优化的反应体系
· 每个反应产生高达150-200 μg的RNA产物
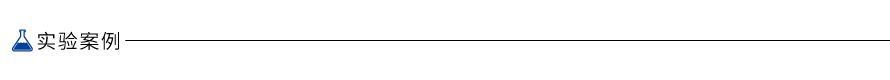
图1. 逆转录方案
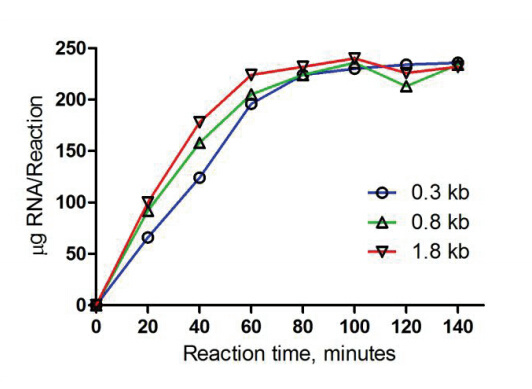
图2. 反应时间与产量的关系
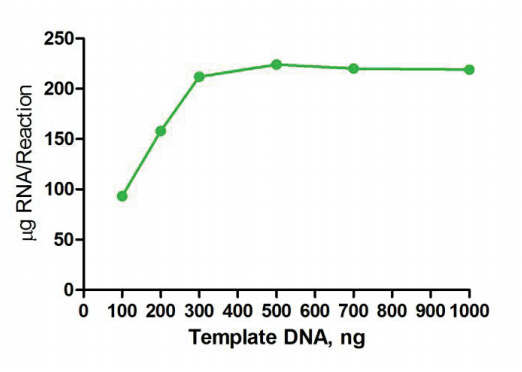
图3. 模板投入量与产量关系

T7 High Yield Transcription Kit 是优化的体外转录试剂盒,T7 RNA Polymerase 从模板DNA T7 的启动子下游开始合成与DNA 中一条链互补的RNA,简单快速获得大量的RNA 分子,转录时可在底物中加入修饰的核苷酸,制备生物素或染料标记的RNA。本试剂盒以0.5μg 的模板投入量可以产生150 μg-200 μg 的RNA,转录合成的RNA 可用于诸如RNA 结构与功能研究、RNA酶保护、探针杂交、RNAi、显微注射及体外翻译等多方面的下游应用。


-20℃保存
1. 模板选择
带有双链T7启动子的线性化质粒、PCR产物或者合成的DNA片段都可以作为T7 体外转录模板,推荐浓度0.5 μg/ul;
(1)质粒:质粒必须完全线性化,可以使用酶切或者反向PCR得到线性化的质粒,线性化的质粒请确保双链为平末端或编码链5’端为突出结构。 质粒线性化后,建议纯化后再作为模板体外转录,以避免RNase、蛋白、RNA及盐残留对体系的影响。每个反应建议投入1 µg线性化质粒作模板;
(2)PCR产物模板:需电泳确认产物的单一性,建议每个反应体系中投入0.1 - 0.5 µg 模板;
(3)合成的DNA模板: 推荐每个反应体系中投入0.1 - 0.5 µg 模板。
2. 转录产物产量低可能的原因及建议。
(1)产物长度小于300nt时,建议提高产物的投入量至2μg,适当延长反应时间。
(2)阳性对照,试剂盒中提供的阳性模板大小在500bp左右,对于阳性对照的实验设计可以在选择反应2h后从20μl的体系中取出5-10μl确定产量,剩下的体积继续反应至实验组的反应时间相同后确定产量。
(3)不同的纯化方式产生的损失是不同的。
(4)实验模板本身原因导致产量低,请尝试以下方案解决:
a. 重新纯化模板;
b. 确定模板定量以及其完整性;
c. 延长37℃反应时间;
d. 加大模板投入量;
e. 尝试其它的启动子和RNA 聚合酶。
3. 短片段转录产物产量低
转录起始片段短会抑制反应,转录产物小于0.3 kb 时,延长反应时间或增加模板量可以提高RNA 产量,过夜反应(16 h) 或者使用2 μg 模板可以使RNA 产量最大化。
4. 产物电泳拖尾现象
电泳过程中有拖尾现象,可能原因:
a. 实验操作过程被RNA酶污染;
b. DNA模板被RNase污染:体系中的RNA 酶抑制剂只能抑制痕量的RNA 酶残留;
c.建议重新纯化模板DNA,并在实验过程中使用RNase-free 的枪头和EP 管,佩戴一次性乳胶手套和口罩,所有试剂均用RNase-free H2O 配制。
5. RNA 产物片段大于预期
如果电泳显示产物条带大于预期,可能原因:
a. 质粒模板可能没有完全线性化;
b. 有义链3’端为突出结构;
c. RNA 存在未完全变性的二级结构;
建议确认模板结构,并将电泳方式由琼脂糖胶换成变性胶来检测RNA 产物。
6. RNA 产物片段小于预期
如果电泳显示产物条带小于预期大小,可能原因:
a. 模板序列中包含类似于T7 RNA 聚合酶的终止序列;
b. 模板中GC 含量高形成高级结构;
c. RNase 污染;
不同的聚合酶识别不同的终止序列,若是模板中含有终止结构,建议尝试不同的RNA 聚合酶。如果模板为高GC,建议加入SSB 蛋白,以提高转录效率。出现产物条带与预期不一致,请跑变性胶检测产物。
7. 针对大片段和小片段,转录的效率如何?
大片段会出现条带弥散的情况,因为片段越长酶越容易从模板上脱落,所以得到的产物条带就不是那么集中,其他竞品公司的产品也会出现类似的情况。短的模板小于300nt的,较短的转录其实对反应有抑制作用,所以要适当延长反应时间,可以过夜16h。因为模板和酶进行结合时识别启动子的过程需要时间,所以模板太短时会对反应造成抑制作用,同时建议增加模板量至2μg。
8. sgRNA条带模糊。
sgRNA是100nt左右的单链RNA,在水溶液中容易形成二级结构,因此电泳时会位置会发生变化,采用加速冷冻或者甲酰胺变性凝胶电泳可以改善电泳结果。
9. 模板中间有一段Poly T中止序列,后面的序列可以转录出来吗?
模板中有发卡结构会影响转录,序列一般不会影响转录。
10. 使用TR101时的模板一定要是双链吗?
至少T7启动子要是双链的。
11. 使用质粒作为模板时,在线性化的过程中,为什么需要使用平末端或者5’突出末端的限制性内切酶进行线性化?
原因和环状质粒为模板相似,都是会因为没有终止子而无限循环下去,从而导致生成的产物片段大小不一。
12. 体外转录试剂盒适用的片段范围是多少?
最小做过21bp的siRNA(TR102),最大做过10kb。
13. 模板中存在高级结构(高GC或是茎环结构),怎么做可以提高产量?
提高温度,如果有很多高级结构存在可以建议加入SSB蛋白。
14. 模板中存在类似于T7终止序列(也是一种茎环结构)怎么做可以提高产量?
降低反应温度。
15. 合成的RNA纯化方式?
|
方式 |
优点 |
缺点 |
|
酚/氯仿 |
便宜 |
可能会残留游离的核苷酸 |
|
柱提法 |
将游离的核苷酸去除干净 |
贵 |
|
切胶回收 |
产物均一 |
- |
|
磁珠法(推荐) |
快速且回收率高 |
- |
16. TR101可以用于合成mRNA吗?
可以,但是要自己购买帽子类似物,说明书中提供的加帽RNA体系就是合成mRNA的体系,里面GTP和加帽类似物的浓度比例建议为1:4。
17. 模板投入量增加为2μg时,NTP的量以及DNA酶的量是否需要调整?
模板投入量增加为2μg时,NTP的量不用调整,若担心模板消化不彻底,可将DNA酶的量从1μl提高至3μl;
18. 阳性对照模板大小是多少?对照组投入0.5μg产出是多少?
Control Template的长度约500bp,投入0.5μg,产出约150-200μg,最低130μg(转录后直接用Qubit测量浓度)。
19. TR101中,有预混RNase 抑制剂吗?
转录酶有预混的RNase 抑制剂,体系中的RNA 酶抑制剂只能抑制痕量的RNA 酶残留,建议在实验过程中使用RNase-free 的枪头和EP 管,佩戴一次性乳胶手套和口罩,所有试剂均用RNase-free H2O 配制,从而避免RNase的污染。
20. TR101可以合成dsRNA吗?
可以,但是TR101里面少一个酶(RNase T1:作用是降解单链RNA和5’端的3个G碱基),所以得到的dsRNA里面会有单链RNA,并且产物5’端有3个G碱基。
21. T7启动子后面带有三个GGG的作用是什么?
GGG的作用是提高转录效率的。
相关产品





