VAHTS Pathogen DNA&RNA Multiplex PCR Mix
助力病原tNGS准确快检的RT兼容多重扩增试剂

病原微生物检测;环境微生物鉴定;食品安全检测;科学研究(基因功能研究)

· 兼容逆转录体系:逆转录后,无需纯化,可直接进行多重扩增
· 优异的扩增性能:对于不同重数的panel,均展示出优异的检出率、扩增特异性和均一性
· 严格的背景菌质控:生产车间洁净、生产人员专业、质控方案细致,严控背景菌,为病原靶向检测保驾护航

VAHTS Pathogen DNA&RNA Multiplex PCR Mix是针对DNA和RNA病原微生物共检测开发的多重扩增试剂,采用了多种热启动技术搭配精心优化的缓冲,兼容逆转录体系,可实现快速、高特异的多重扩增,适用于靶向扩增子文库构建。本试剂适用的Panel重数为20 - 1000 (Panel GC范围为20% - 85%)。此外,本试剂的原材料经过严格的背景菌质控,可有效预防假阳性的产生,以保证检出结果真实可靠。同时经过严格的质量控制和功能验证,较大程度保证多重扩增反应的稳定性和重复性。

将人293T细胞gDNA和混合病原核酸以1000:1质量比混合构建病原模型(其中,混合病原核酸由17种DNA和RNA病原等质量比混制而成),逆转录后不纯化,取9.5μl逆转录产物通过两轮PCR构建扩增子文库,比较不同多重扩增试剂的性能(分别采用207重和492重病原Panel,快速程序下完成多重扩增)。
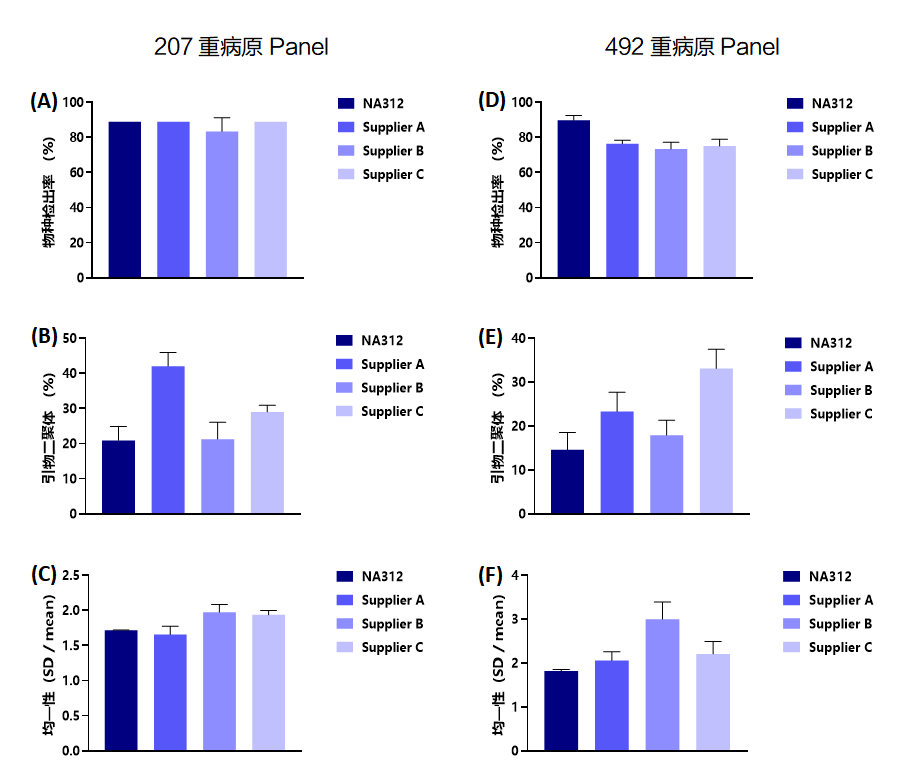
如图所示,无论使用207重Panel还是492重Panel,Vazyme #NA312均具有优异的检出率、特异性和均一性。


 -30 ~ -15℃保存,≤0℃运输,请勿将本品置于温度高于室温的环境中存放。
-30 ~ -15℃保存,≤0℃运输,请勿将本品置于温度高于室温的环境中存放。
Q1:扩增产量偏低
A1:(1) 确认模板是否降解,重新定量模板,确认模板起始量体积是否正确,检查引物是否降解。
(2) 若模板质量较差,可适当提高循环数或使用高质量模板。
(3) 若Panel重数较高时,可通过调节扩增程序,如增加退火和延伸时间。
(4) 降低退火温度(间隔1 ~ 3℃),必要时进行退火温度梯度测试。
(5) 请确认每一步体系以及程序是否按照说明书进行,并注意每一步骤中各项操作细节。
(6) 产物纯化磁珠干燥环节,不能时间过长导致磁珠过于干燥,过于干燥也会降低产量。
Q2:引物二聚体较高
A2:(1) 可以适当调整引物的使用量。
(2) 可适当提高模板投入量,减少引物间随机结合概率。
(3) 可减少多重扩增后的纯化乘数,纯化乘数可在0.6 × - 1 ×之间调整。
Q3:存在非特异性扩增
A3:(1) 减少循环数。
(2) 提高退火温度。
(3) 减少引物使用量。
(4) 重新设计引物。
Q4:部分区域漏检
A4:(1) 可能设计的Panel与模板的匹配度不够高,建议对设计的Panel进行功能验证。
(2) 可能模板质量较差,部分区域缺失,需重新使用高质量模板。
(3) 可能引物间GC比例或Tm值差异过大,部分区域扩增困难,建议对不符合条件的Panel重新进行调整。
Q5:文库均一度偏低
A5:(1) 较短扩增子较少:可适当提高磁珠纯化乘数(提高至1.2 ×或1.5 ×)。
(2) 较长扩增子较少:原因可能为模板受损严重或PCR环节扩增不充分,请使用高质量模板或将PCR环节中延伸时间延长。
(3) AT含量高的扩增子较少:增加退火时间或降低退火温度,最低可降至55℃。
(4) GC含量高的扩增子较少:可以通过在扩增体系中添加5% - 10% DMSO。
Q6:气溶胶污染
A6:PCR产物极易产生气溶胶污染,进而导致实验结果不准确、可信度不高等问题。因此,我们推荐您将PCR反应体系配制区和PCR产物纯化区进行强制性的物理隔离,使用专用的移液器等设备,并定时对各实验区域进行清洁(使用0.5%次氯酸钠或10%漂白剂进行擦拭清理),以保证实验结果的可信度。
相关产品
N616-01/02
N411-01/02/03
Equalbit 1 × dsDNA HS Assay Kit
EQ121-01/02
VAHTS Maxi Unique Dual Index Primers Set 1 - Set 4 for Illumina
N34401/N34402/N34403/N34404-01
VAHTS Multiplex Oligos Set 4/5 for Illumina
N321/N322-01
VAHTS Dual UMI UDI Adapters Set 1 – Set 4 for Illumina
N351/N352/N353/N354
VAHTS Maxi Unique Dual Barcode Primers Set 1 - Set 4 for MGI
NM34401/NM34402/NM34403/NM34404—01





