ClonExpress Ultra One Step Cloning Kit V2
兼容高效的快速克隆试剂盒

快速克隆、高通量克隆、无缝克隆;载体构建、同源重组

· 兼容:1-5个片段,长同源臂、同源臂高GC/高AT、未纯化体系
· 高效:5-30min完成重组,克隆数多、阳性率高

ClonExpress技术是一种简单、快速并且高效的DNA无缝克隆技术,可快速将插入片段定向克隆至任意载体的任意位点。Vazyme #C116是新一代的快速克隆试剂盒,可以高效兼容1-5个片段同源重组,使用高度优化的2 × CE Mix,50℃反应5 - 30 min即可进行连接,对同源臂长度、同源臂GC含量、未纯化体系等兼容性更广,提高了复杂体系的克隆成功率。

1. 克隆数多
测试19个体系,Vazyme #C116克隆数均优于同类型产品Supplier A、Supplier B和Supplier C;测试9个体系,Vazyme #C116克隆数均优于同类型产品Supplier D。
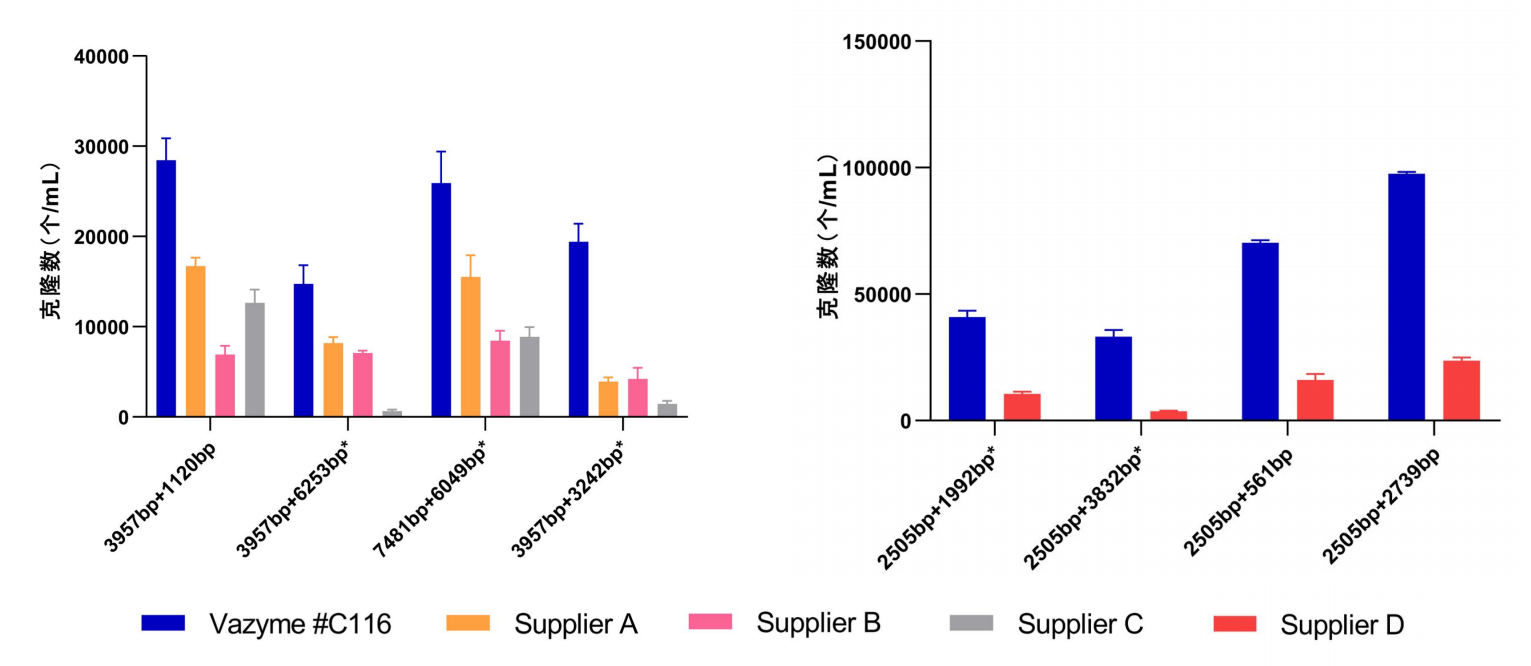
图1. Vazyme #C116与同类型产品克隆数比对(仅展示部分体系)
2. 阳性率高
测试30个体系,Vazyme #C116阳性率在90%以上。
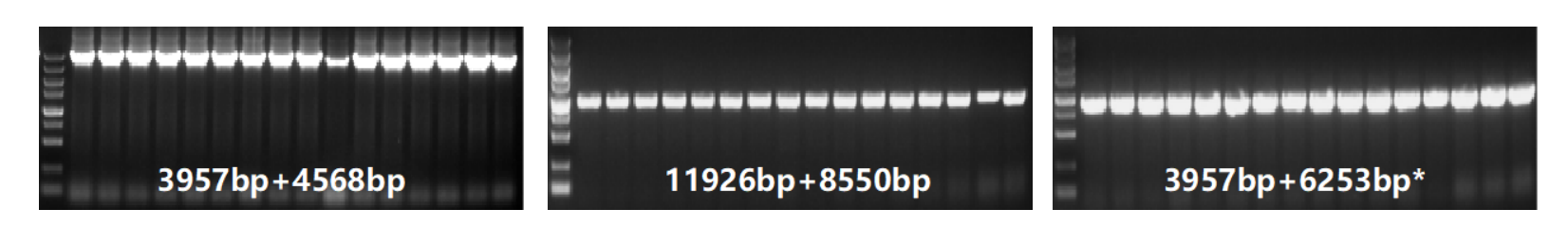
图2. Vazyme #C116阳性率鉴定(仅展示部分体系)
3. 兼容性广
测试同源臂GC含量为86.7%/6.7%的体系、同源臂长度为35bp的体系及片段未纯化体系,阳性率皆在90%以上。
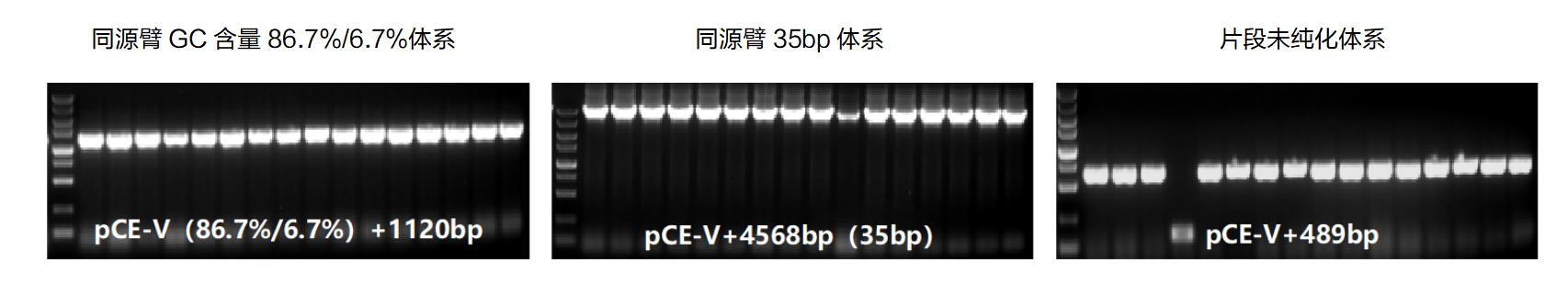
图3. Vazyme #C116兼容性测试
注:“+”前面数字表示载体大小,pCE-V为3957bp;“+”后面数字表示片段大小,带“*”表示为多片段插入


-30 ~ -15℃保存
Q1:引物如何设计
1. 引物由三部分组成:同源臂(15-20 bp,不计算酶切位点和残留碱基,GC含量40%-60%)+酶切位点(按需保留或舍弃)+特异性引物(引物Tm值由特异性序列决定,计算不包括同源臂的序列)
2. 引物设计:官网引物设计软件CE Design,选择相应模块进行设计。
3. 载体的线性化方式有三种:双酶切、单酶切和反向PCR,优先选择双酶切。
Q2:阳性对照不长克隆或很少。
1. 平板抗性使用错误:C112,C113提供的对照载体的抗性为Amp+抗性;C115提供的对照载体的抗性为Amp+,Kan+双抗性;C116提供的对照载体的抗性为Amp+抗性。
2. 感受态细胞效率低:感受态细胞的转化效率需大于108 cfu/μg。可进行简单检测,转化0.1 ng 质粒,取1/10进行涂板,生长1,000个菌斑,估算转化效率为108 cfu/μg;重组产物的转化体积不应超过感受态细胞体积的1/10,否则会降低转化效率;选择克隆用感受态细胞
(如Fast-T1/DH5α/XL10),不能选择表达感受态细胞。
Q3:平板上未长出克隆或克隆数很少
1. 引物设计不正确:引物包含15 - 20 bp同源臂(不计算酶切位点和残留碱基),GC含量40% - 60%。
2. 线性化克隆载体和插入片段扩增产物的使用量不足/过量,或者比例不佳:尽量按照说明书中推荐的量和比例配制重组反应体系。
3. 载体和插入片段不纯,抑制反应:未纯化DNA使用体积不应超过2 μl(反应体系体积的1/5); 建议线性化载体、PCR产物进行凝胶回收纯化,纯化产物溶解在ddH2O中。
4. 感受态细胞效率低:感受态细胞的转化效率需大于108 cfu/μg。可进行简单检测,转化0.1 ng 质粒,取1/10进行涂板,生长1,000个菌斑,估算转化效率为108 cfu/μg;重组产物的转化体积不应超过感受态细胞体积的1/10,否则会降低转化效率;选择克隆用感受态细胞
(如Fast-T1/DH5α/XL10),不能选择表达感受态细胞。
Q4:假阳性/测序无信号/空载体
1. 质粒载体残留导致的假阳性:设置阴性对照来排查,如果阴性对照长了很多,可能是模板投入量过多或者未进行Dpn I 消化。
若以质粒为模板PCR获得片段/载体:质粒投入量不宜过多(<1ng),否则可能导致Dpn I消化不完全从而造成假阳性。建议PCR产物进行凝胶回收纯化,纯化产物溶解在pH 8.0的ddH2O中。
2. 挑斑方法不合适:重组产物3'端与5'端未连接,需要到感受态细胞中进行修复,斑点相对来说会小点;平板营养不均匀会导致斑点大小有差异;重组质粒相对原始质粒来说,有可能会影响细胞的生长。建议选取平板上某一块区域,同时挑选大斑和小斑,以增加挑到重组产物的概率。
3. 菌检引物不合适:建议使用载体通用引物或者引物一端在载体上,一端在目的片段上。如果用目的片段引物进行菌液PCR,可能会出现菌检有结果而测序无结果。
Q5:菌液PCR无条带
1. 引物不正确:推荐使用载体的通用引物进行菌检,或至少使用一条通用引物。
2. PCR体系或程序不合适:没有目的条带也没有空质粒条带,建议优化PCR体系、程序;或者提取质粒,以质粒做模板PCR验证;或者进行酶切验证。
3. 重组失败:只有空质粒的条带,说明重组不成功,载体线性化不完全,建议优化酶切体系。
Q6:多数克隆不含插入片段或含有不正确的插入片段
1. PCR产物混有非特异扩增产物:优化PCR体系,提高特异性;胶回收PCR产物;鉴定更多的克隆。
2. 克隆载体线性化不完全:可通过阴性对照检测载体是否线性化完全,优化酶切体系,提高限制性内切酶使用量、延长酶切反应时间、胶回收纯化酶切产物。
3. 反应体系中混入了相同抗性的质粒:PCR扩增模板为环状质粒时,如扩增产物未纯化直接用于重组反应时推荐Dpn I 消化,或者对扩增产物进行胶回收纯化。
Q7:插入片段出现碱基突变
1. 测序的样本数:如果只测了一个样本,不一定可信,需要多测几个样本。
2. 分析测序结果:检查突变处的测序信号是否有问题,若为双峰或者杂峰则不一定可信。
3. 检查突变位点:如果多个结果突变位点一致,可能是从模板上引入的或者模板序列与NCBI上不一致。
4. 插入片段在PCR获得时建议使用高保真聚合酶。
5. 若引物处发生碱基突变,考虑是引物合成问题,建议重新合成引物进行实验。
相关产品
2 × Phanta Max Master Mix (Dye Plus)
P525-01/02/03
2 × Phanta Flash Master Mix(Dye Plus)
P520-01/02/03
C505-02/03
C502-02/03
P222-01/02/03/04
C404-01





