FastPure EndoFree Plasmid Midi Kit
无内毒素质粒中量提取试剂盒
高产无内毒,可视化操作,转染级别,15-50 ml质粒中提

质粒DNA提取;产物可用于酶切、PCR、测序、连接转化、转染

本试剂盒适用于提取15 - 50 ml过夜培养的菌液,采用优化的碱裂解法裂解细胞,通过独特的硅胶膜吸附技术与特殊的Buffer ERB和Buffer ERW溶液,可特异性结合质粒并有效地去除内毒素、蛋白、基因组等杂质。同时,添加指示剂的独特P2溶液,可以通过颜色的变化,指示裂解、中和是否充分,保证提取质量,实现可视化操作。提取的质粒DNA内毒素残留低,可适用于多种细胞的转染及各种常规操作,包括酶切、PCR、测序、连接等实验。

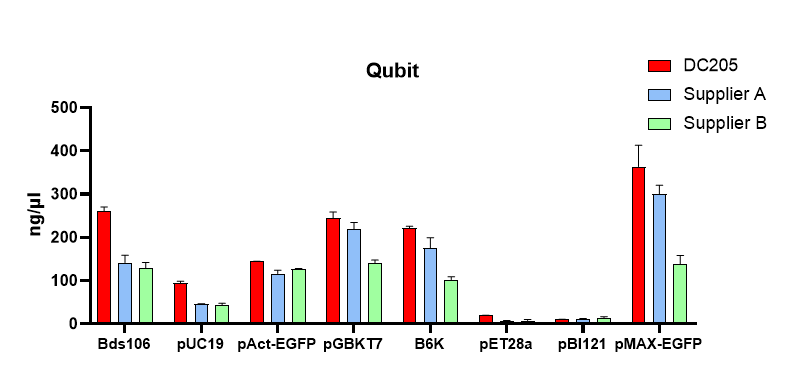
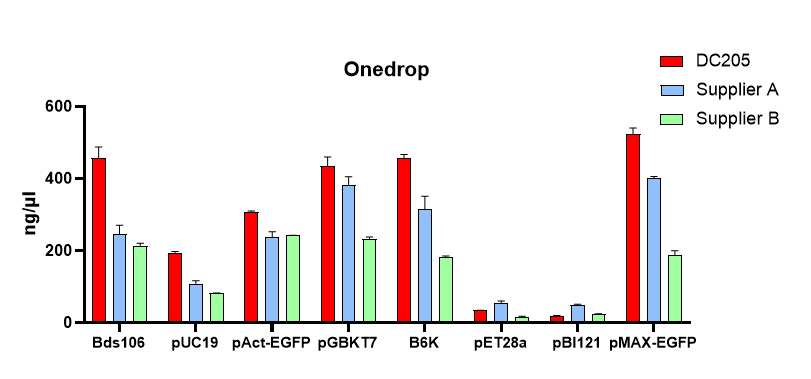
高产高纯:50 ml 高拷贝菌液,可获得300 μg质粒
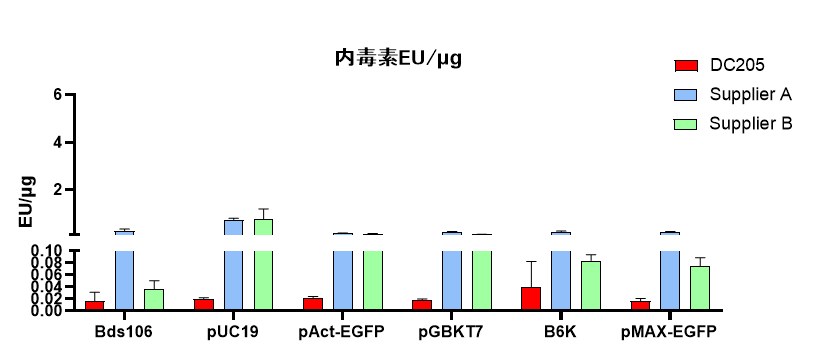
无内毒素:高拷贝质粒内毒素残留≤0.1 EU/μg
可视化操作:显色试剂,展示中和效果,为产物质量保驾护航

1、高产量
2、无内毒
3、可视化操作
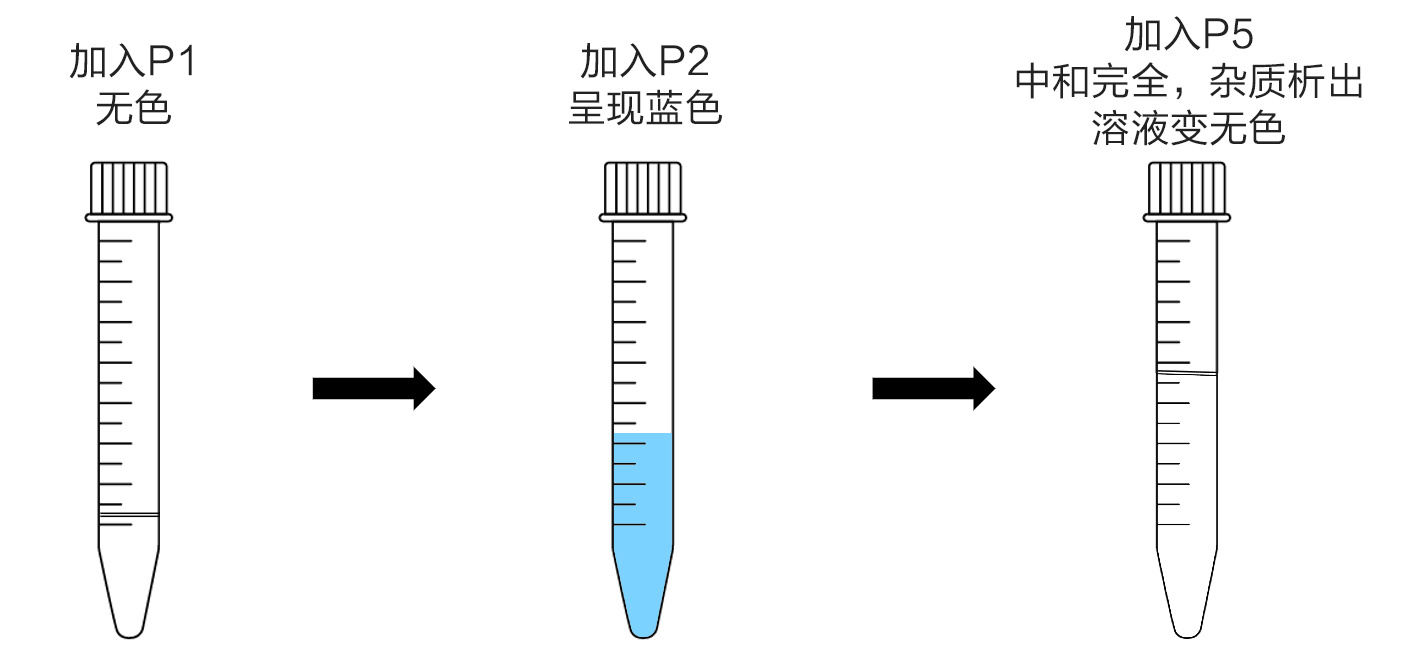
注:可视化操作可以规避质粒提取过程中,中和不完全带来的纯度和浓度低的问题



BOX 1:2 ~ 8 ℃保存,根据不同目的地调整运输方式;
常见问题1:质粒DNA产量低
原因1:低拷贝
解决方案:不同质粒载体因拷贝数差异会造成产量有明显的波动。对于低拷贝质粒应加大菌液使用量,使用100 ml过夜培养的菌液,同时按照比例增加Buffer P1、Buffer P2和Buffer P5的用量,洗脱液应65 ℃预热,以增加提取效率,其他步骤相同。低拷贝质粒,例如:pET系列,pWE15,SuperCos,pBR322,pACYC及其衍生载体,pSC101及其衍生载体等
原因2:大片段质粒(>10kb)
解决方案:洗脱液65 ℃预热,以增加提取效率,其他步骤相同
原因3:宿主菌株差异
解决方案:不同宿主对质粒产量也会产生影响,建议使用end A-大肠杆菌菌株, 如DH5α、TOP10及XL10等
原因4:Buffer P2析出
解决方案:Buffer P2低温时易析出,37 ℃加热至完全溶解,混匀后使用
原因5:菌液保存不当
解决方案:菌种保存过程中存在质粒丢失现象,建议培养细菌前最好先划线或涂布平板活化,以稳定产量
原因6:菌液培养时间过长
解决方案:菌的培养时间不要超过16 h,可控制在12 - 14 h
原因7:吸附柱长时间暴露于高温等不良环境
解决方案:进行08-1/常规提取步骤/步骤6
常见问题2:基因组污染
原因:裂解操作不当
解决方案:加入Buffer P2后,需温和颠倒混匀;处理多个样本时,裂解时间不要超过5 min
常见问题3:纯度低
原因1:盐离子残留
解决方案:用Buffer PW1和Buffer PW2各漂洗1次;建议沿吸附柱管壁四周加入,或加入后颠倒混匀2 - 3次,有助于减少盐离子残留
原因2:乙醇残留
解决方案:空离后可室温开盖放置5 min,尽量去除乙醇残留
常见问题4:内毒素残留高
原因1:加入Buffer P5后未充分混匀
解决方案:加入Buffer P5后应充分混匀至蓝色消失,若蓝色未消失可增加上下颠倒次数至20次,离心后上清应为澄清状
原因2:Buffer ERB析
解决方案:Buffer ERB低温时易析出,37 ℃加热至完全溶解,混匀后使用
原因3:加入Buffer ERB未充分混匀
解决方案:加入Buffer ERB后应充分混匀,可增加上下颠倒次数至15次
常见问题5:RNA残留
原因1:RNase A活性下降
解决方案:已加入RNase A的Buffer P1长时间室温放置可能会出现酶活下降,使用后应及时放回2 ~ 8 ℃
原因2:菌液体积过高
解决方案:由于菌体数量过多(>100 ml),导致Buffer P1中RNase A不足以消化菌体中的RNA,建议减少菌液体积
常见问题6:吸附柱堵塞
原因:离心机离心力过小
解决方案:不同离心机相同转速对应离心力不同,2,500 × g≤离心力≤8,000 × g
相关产品
ClonExpress MultiS One Step Cloning Kit
C113-01/02
ClonExpress Ultra One Step Cloning Kit
C115-01/02
5 min TA/Blunt-Zero Cloning Kit
C601-01/02
C311-01/02
T101-01/02





