2 × KeyPo SE Master Mix(Dye Plus)
高成功率与快速扩增“兼具”的高保真酶预混液

基因鉴定、复杂体系、高通量建库

2 × KeyPo SE Master Mix(Dye Plus)是基于BioSmart平台定向筛选开发的兼具扩增成功率高和快速扩增(15 sec/kb)的高保真酶预混液。新一代热启动技术和高度适配的缓冲体系使其可在40 kb以内进行高特异的单重PCR,在300 bp - 15 kb内进行高度均一性的多重PCR,将GC偏好性降至较低程度。适用于常规模板、超长片段、高GC/高AT体系、含尿嘧啶模板、动植物裂解产物及细胞/全血/叶片直扩。只需加入模板和引物即可进行扩增,使用方便;含电泳指示剂,PCR反应完即可直接点样电泳。

超长扩增: gDNA≤40 kb 、质粒≤30 kb、 λDNA≤17.8 kb、 cDNA≤15 kb
多重扩增:兼容300 bp-15 kb的12重扩增
高成功率:复杂体系轻松扩增(高GC/高AT、裂解产物、菌斑/菌液、全血/细胞/叶片直扩等)
简单快速:扩增速度15-30 sec/kb,PCR反应完即可直接点样电泳

1.超长扩增
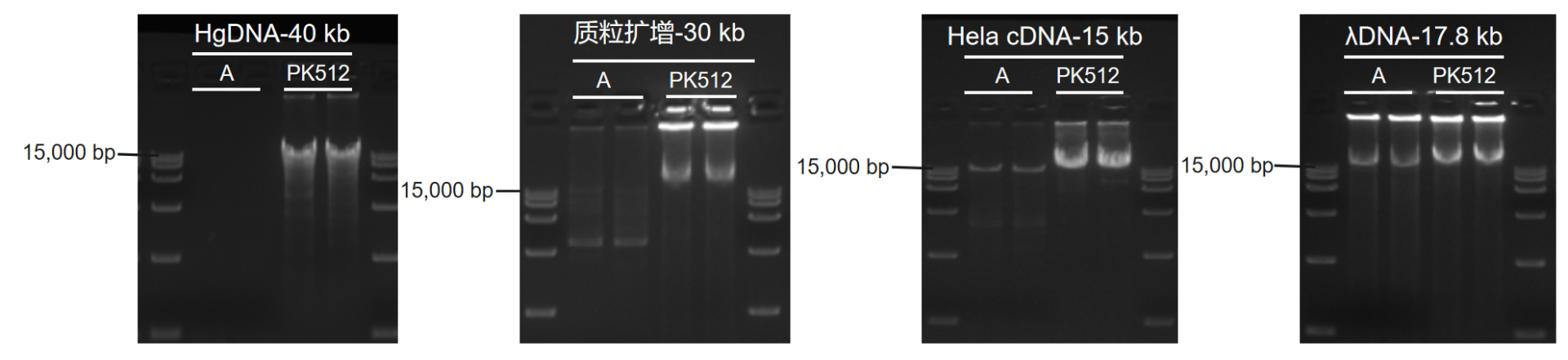
使用2 × KeyPo SE Master Mix(Dye Plus)(Vazyme #PK512,简称PK512)及市售其他高保真酶(Supplier A),按照各自说明书推荐体系和程序扩增不同长度模板。结果显示:PK512可成功扩增40 kb的gDNA、30 kb的质粒、17.8 kb 的λDNA、15 kb的cDNA;PK512扩增长度优于Supplier A。
2.多重扩增
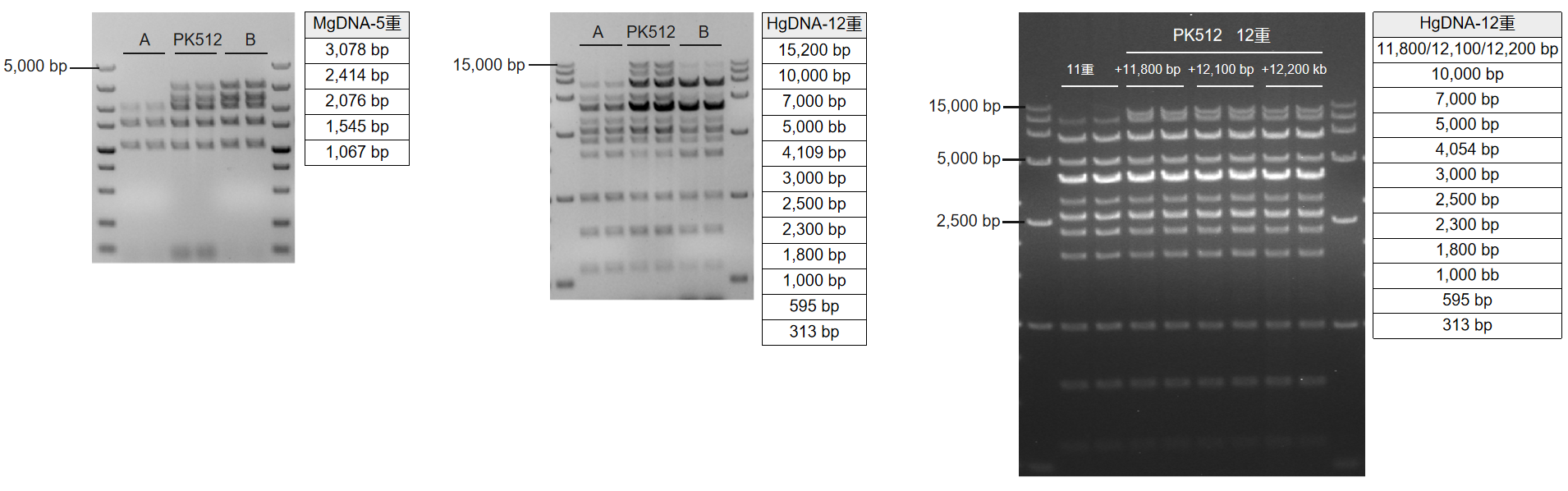
使用PK512及市售其他高保真酶(Supplier A、Supplier B),按照各自说明书推荐体系和程序扩增不同重数的体系。结果显示:PK512在300 bp - 15 kb内可进行高度均一性的12重PCR;PK512扩增重数优于Supplier A、Supplier B。
3.高成功率
(1)扩增程序
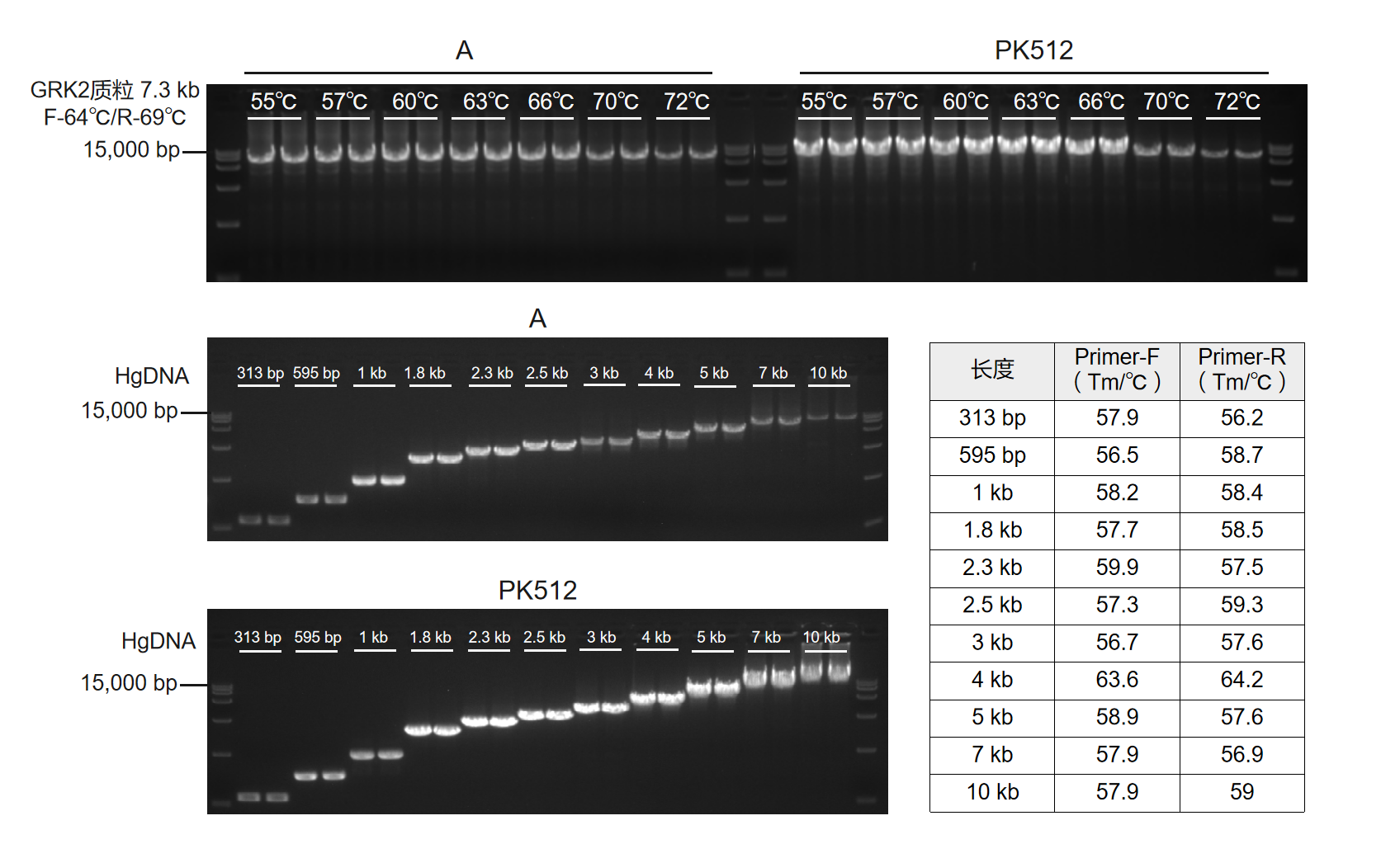
使用PK512及市售其他高保真酶(Supplier A),测试扩增程序兼容性。结果显示:PK512引物Tm值兼容性广,上游引物(F)Tm值为64℃、下游引物(R)Tm值为69℃时,退火温度使用55-72℃均可成功扩增;PK512可在一台PCR仪中同时成功扩增11个不同长度/不同Tm值的片段;PK512扩增产量优于Supplier A。
(2)模板类型
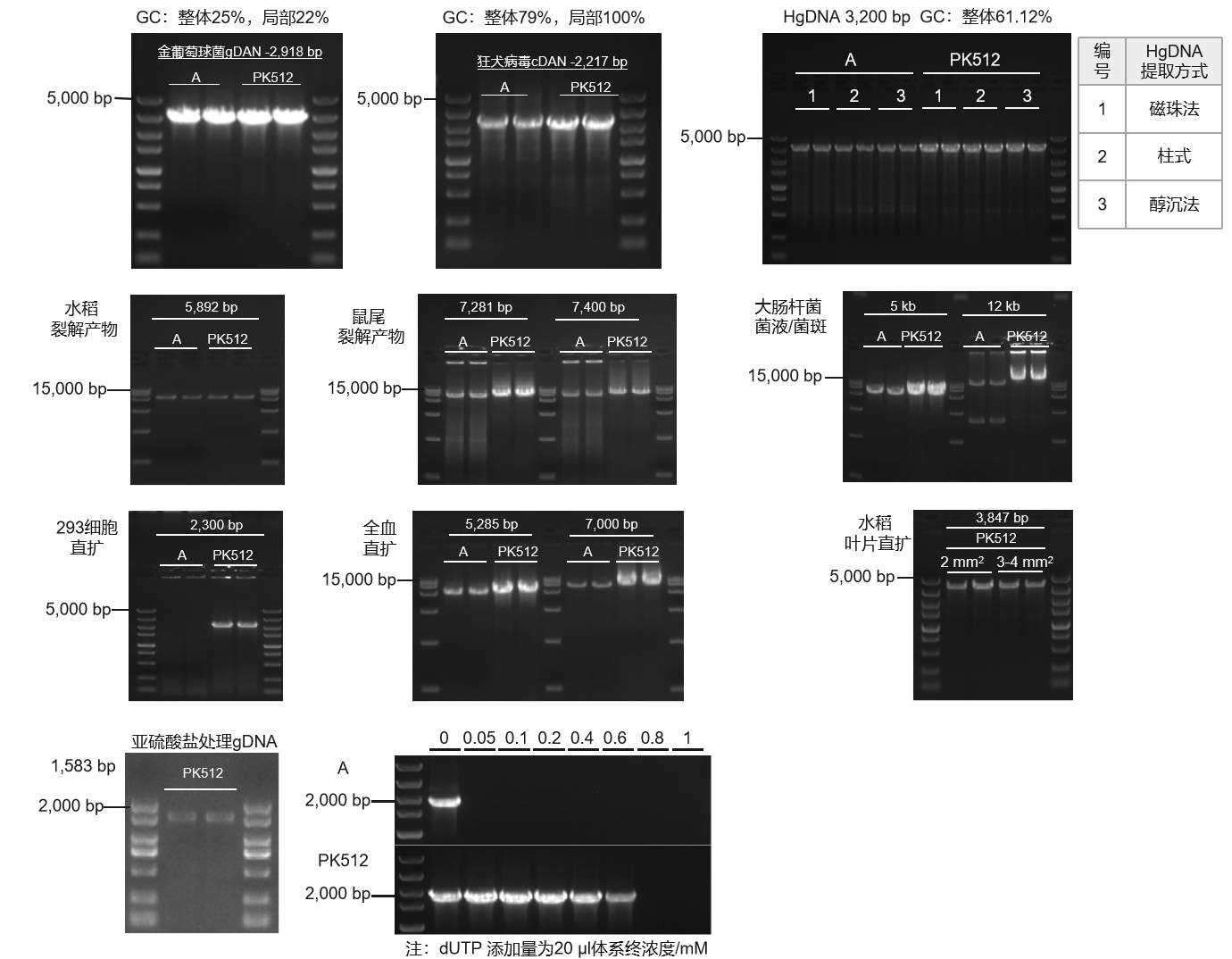
使用PK512及市售其他高保真酶(Supplier A),测试不同模板类型兼容性。结果显示:PK512可兼容高GC/高AT体系、磁珠法/柱式法/醇沉法提取的gDNA、动植物裂解产物、菌斑/菌液、细胞/全血/叶片直扩、亚硫酸盐处理gDNA/含dUTP碱基;PK512扩增成功率、特异性、产量优于Supplier A。


 -30~-15℃保存,≤0℃运输
-30~-15℃保存,≤0℃运输
Q1:PK512以cDNA为模板扩增时,cDNA推荐投入量?
A1:cDNA投入量建议不超过总反应体系的1/10。若使用Vazyme #R312/R212逆转(RNA投入量1 μg),建议50μl体系投入1-2μl原液即可。若使用Vazyme #R412逆转(RNA投入量1 μg),建议50μl体系投入1μl原液即可,投入过多可能会出现PCR产物黏稠和电泳堵胶孔。
Q2:PK512可兼容的模板类型?
A2:常规模板(gDNA、cDNA、质粒),含尿嘧啶模板(甲基化DNA、扩增时加入dUTP),高GC/高AT模板(GC含量整体24%-79%,局部22%-100%)、动植物裂解产物、菌液/菌斑、全血/细胞/叶片直扩等。
注:细胞直扩参考方法:取500 μl细胞悬浊液,离心(≤5000 rpm,4-5 min),弃上清;加入1 ml PBS,用移液枪吹打混匀,离心,弃上清,重复清洗4-5次;然后用水稀释到适合的细胞浓度使用,建议20 μl体系投入104-6个细胞。
叶片直扩参考方法:将叶片,直接剪2-4 mm2,投入50 μl反应体系中,涡旋混匀后进行PCR
Q3:PK512是否可以扩增酵母?是否可以扩增含U碱基引物?
A3:Vazyme #PK512-C3(扩增速度1 min/kb)更适宜扩增酵母菌斑/菌液及含U碱基引物;PK512常规货号(PK512-01/02/03)因速度快(15-30 sec/kb),对于上述两类样本,个别体系可能扩增不稳定。
Q4:扩增效率低,实验组无扩增条带。
A4:(1) 引物
检查人工合成的引物是否因存储条件不当而降解;引物设计是否合理,可利用BLAST检查引物特异性或重新设计引物。
(2) 模板
长期放置、反复冻融会导致模板断裂、开环或降解,应使用新鲜制备的DNA双链作为模板;模板为粗品,存在抑制物,建议降低模板浓度;若模板为cDNA,要确认逆转录所用RNA的纯度及完整度。
(3) 酶
反应所用的酶失活,建议更换新酶或用另一来源的酶重新实验。
(4) 扩增体系
反应体系配制错误,建议重复实验。
(5) 反应程序
检查变性温度是否准确,PCR仪指示温度与实际温度是否相符,如果温度过高,酶在前几个循环就迅速失活,温度过低则模板变性不彻底;退火温度不合适,可对退火温度设置梯度,摸索合适的退火温度;检查延伸时间是否充足。
Q5:扩增的条带亮度不太亮。
A5:(1) 引物
检查人工合成的引物是否降解。
(2) 模板
首先确认模板的质量,长期放置、反复冻融会导致模板断裂、开环或降解,应使用新鲜制备的DNA双链作为模板;如果模板没有了,可用首次扩增产物按倍比稀释后作为模板进行二次扩增。
(3) 反应程序
可梯度摸索适宜退火温度;延长延伸时间,提高循环数。
Q6:扩增特异性差,非特异性扩增。
A6:(1) 引物
引物设计不够优化。引物与靶序列有非特异性互补或自身聚合成二聚体,可降低引物浓度进行优化,必要时重新设计引物。
(2) 模板
模板不纯,被污染,需重新制备模板。
模板降解或过量,通过电泳检查模板完整性及浓度,必要时重新纯化模板。模板的使用量请参考说明书。
(3) 反应程序
反应程序不够优化。如果出现比目的条带小的杂带,可通过提高退火温度,降低循环数调整;如果出现比目的条带大的杂带,可缩短延伸时间、降低循环数。
Q7:扩增产物跑胶条带弥散或拖尾。
A7:(1) 胶
制胶时要使胶完全融化。
(2) 引物
检查引物是否降解。
(3) 模板
模板降解或过量,可通过电泳检查模板完整性及浓度,必要时重新制备模板。模板的使用量请参考说明书。如果目的条带较长,模板是cDNA,要确认逆转录所用RNA的纯度及完整度,逆转录时不加随机引物重新逆转录。
(4) 反应程序
反应程序不够优化。退火温度不合适,可对退火温度设置梯度,摸索合适的退火温度。
Q8:空白对照出现扩增产物。
A8:(1) 引物设计不合理
扩增序列与非目的扩增序列有同源性,PCR也可以扩增出非靶序列的序列。
(2) 若扩增产物条带大小与目的条带一致,说明有污染
更换新的Mix、水或引物重复实验。反应体系在超净工作台内配制,减少气溶胶污染。
(3) 为了避免靶序列受到整个基因组或大片段的交叉污染,操作时应小心轻柔,防止将靶序列吸入加样枪内或溅出离心管外。
(4) 为了避免靶基因受到空气中小片段核酸污染,可用巢式PCR方法减轻或消除污染。
相关产品
MD101-01/02
MD103-01/02
MD102-01/02
MD104-01/02
GR501-01/02
FastPure Gel DNA Extraction Mini Kit
DC301-01
ClonExpress Ultra One Step Cloning Kit V2
C116-01/02
Ultra-Universal TOPO Cloning Kit
C603-01/02





